Perbedaan antara titik akhir dan titik kesetaraan
- 2082
- 176
- Mr. Miguel Schultz
Titik akhir dan kesetaraan adalah dua konsep terpenting dalam titrasi kimia. Teknik titrasi dapat terjadi dalam reaksi redoks, reaksi asam-basa, dan banyak lagi reaksi. Ini sebagian besar digunakan dalam reaksi asam-basa di mana ia melibatkan netralisasi larutan lain dengan yang lain untuk menentukan konsentrasi yang tidak diketahui. Pada dasarnya, larutan standar dengan konsentrasi yang diketahui dituangkan dengan hati -hati ke dalam larutan lain yang disebut analit dengan konsentrasi yang tidak diketahui untuk menghitung konsentrasinya.
Selama proses titrasi, ada dua tahap yang tercapai, yaitu. titik akhir dan kesetaraan. Titik kesetaraan, juga disebut titik stoikiometrik, secara singkat, adalah titik di mana mol dari dua larutan, asam dan basa, setara atau sama. Tahap terjadi sebelum titik akhir, yang menandakan penyelesaian reaksi. Dalam beberapa reaksi, mungkin ada banyak titik kesetaraan, terutama pada asam poliprotik dan basa di mana beberapa ion hidroksida ada.
Artikel ini membuka perbedaan utama antara titik akhir dan titik kesetaraan dalam titrasi kimia.

Definisi titik kesetaraan
Titik kesetaraan dalam titrasi asam-basa menandakan penyelesaian reaksi di mana jumlah mol titrant dan analit sama seperti dalam persamaan kimia. Misalnya, dalam titrasi NaOH dan HCl, 1 mol HCl akan sama dengan persis 1 mol NaOH pada titik kesetaraan. Poin ini harus dicapai secara akurat dengan mengelola sejumlah tetes solusi standar untuk konsentrasi yang tidak diketahui. Pipet biasanya digunakan untuk menuangkan tetesan titrant ke dalam labu pengukur di mana analit telah dituangkan dengan indikator tertentu. Indikator penting dalam titrasi asam-basa untuk secara jelas melihat kesetaraan dan titik akhir.
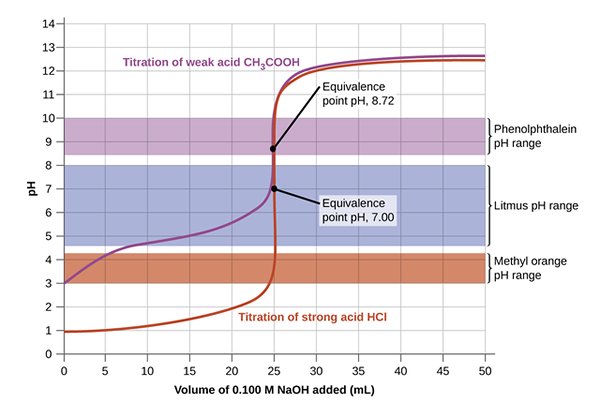
Titrasi asam dan basa dapat terjadi antara basa yang kuat dan basa lemah; basa kuat dan asam lemah; basis yang kuat dan basis yang kuat; atau asam poliprotik yang lemah. Indikator yang berbeda dapat digunakan tergantung pada tipikal solusi yang digunakan untuk titrasi. Misalnya, dalam titrasi NaOH dan HCl, fenolftalein digunakan, sedangkan di NH3 dan hcl indikator metil oranye lebih cocok untuk melakukan perubahan. Jika pH titrant sesuai dengan pH pada titik kesetaraan, titik akhir dan titik kesetaraan dapat terjadi secara bersamaan.
Gambar di bawah ini memberikan pemahaman yang jelas tentang titrasi yang diatur untuk mencapai titik kesetaraan dan kemudian mencapai titik akhir saat warna berubah. Pada awalnya, solusi dengan konsentrasi yang tidak diketahui dituangkan dengan indikator. Kemudian titrant ditambahkan menggunakan burette dengan mengendalikan tetesan dengan katup. Persamaan masamVasam = MbasisVbasis digunakan untuk menghitung konsentrasi yang tidak diketahui dengan manipulasi aljabar yang mencatat bahwa molaritas adalah sejumlah mol per liter.
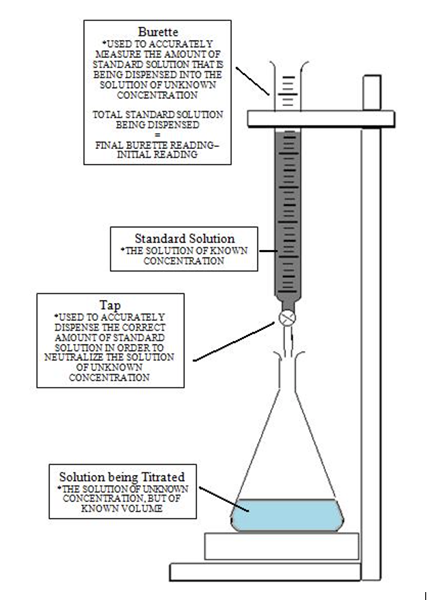
Definisi titik akhir
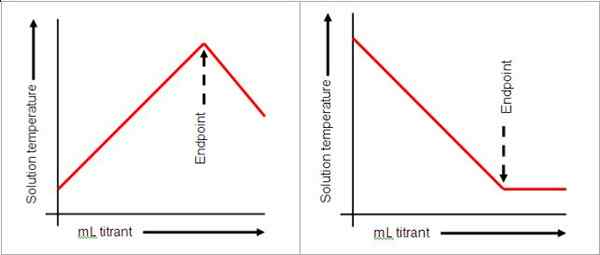
Titik akhir datang setelah titik kesetaraan dalam titrasi. Itu menunjukkan bahwa titik kesetaraan telah tercapai. Titik akhir ini ditunjukkan oleh perubahan warna solusi. Lihat gambar di bawah ini:

Gambar milik: Libretexts Kimia
Untuk mencapai titik akhir, jumlah tetes harus diberikan dengan hati -hati karena satu tetes dapat mengubah pH solusi. Dalam situasi di mana titik akhir telah dilewati, titrasi punggung atau titrasi terbalik dapat dilakukan tergantung pada sifat solusi. Jika terlalu banyak titran telah dituangkan, titik akhir mungkin dilewatkan. Solusinya adalah menambahkan solusi lain dari reaktan yang berbeda secara berlebihan.
Indikator tidak selalu digunakan dalam titrasi. Meter pH dapat digunakan untuk membaca pH sebagai indikasi bahwa reaksi selesai. Dalam basa dan asam yang kuat, pH 7 menunjukkan bahwa reaksi selesai. Namun, perubahan warna adalah cara yang nyaman untuk memantau titik akhir sehingga indikator sering digunakan. Larutan natrium klorida dan asam hidroklorat mencapai titik akhir seperti yang ditunjukkan oleh fenolftalein saat larutan berubah merah muda. Titik akhir tidak selalu menunjukkan akhir reaksi, tetapi penyelesaian titrasi.
Perbedaan antara titik akhir dan kesetaraan
Definisi titik akhir dan kesetaraan
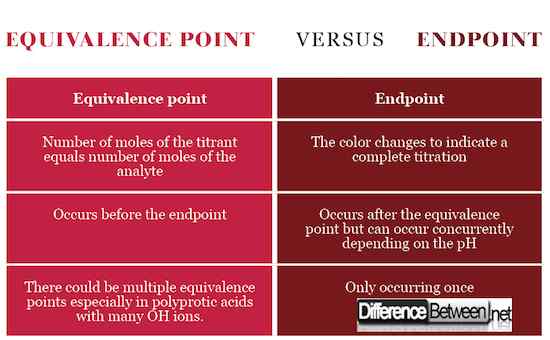
Titik akhir adalah tahap dalam titrasi yang ditunjukkan oleh perubahan warna sebagai tanda bahwa titrasi selesai dan titik kesetaraan telah tercapai. Titik kesetaraan, di sisi lain, adalah tahap tepat sebelum titik akhir yang menandakan titik stoikiometrik dengan jumlah mol yang sama antara analit dan titran sejalan dengan persamaan kimia. Untuk mencapai titik kesetaraan, titrant harus dituangkan secara akurat dan tepat drop demi drop menggunakan burette.
Terjadinya titik akhir dan kesetaraan
Titik kesetaraan terjadi ketika jumlah mol dari titran, larutan standar, sama dengan jumlah mol analit, larutan dengan konsentrasi yang tidak diketahui. Titik akhir terjadi saat warnanya berubah.
Makna titik akhir dan kesetaraan
Titik kesetaraan berarti bahwa titran telah bereaksi sepenuhnya dengan analit sedangkan titik akhir menandakan penyelesaian titrasi. Titik akhir dan kesetaraan dapat terjadi pada saat yang sama jika pH titrant sesuai dengan pH pada titik kesetaraan.
Kesetaraan ayat titik akhir: Bagan Perbandingan
Ringkasan kesetaraan ayat titik akhir
- Titik akhir dan kesetaraan adalah tahap terpenting dalam titrasi kimia
- Titik akhir terjadi setelah titik kesetaraan dan itu menunjukkan penyelesaian titrasi, tetapi tidak selalu akhir dari reaksi.
- Titik kesetaraan terjadi sebelum titik akhir dan menunjukkan reaksi lengkap antara titran dan analit di mana jumlah mol dari titran sama dengan jumlah mol dari konsentrasi yang tidak diketahui
- Titik akhir tercapai ketika warna berubah jika indikator telah digunakan
- Asam lemah lainnya dapat memiliki beberapa titik kesetaraan tetapi hanya satu titik akhir
- Titik kesetaraan juga disebut titik stoikiometrik

