Perbedaan antara elektrofil dan nukleofil
- 1660
- 189
- Richard Hegmann MD
Elektrofil dan nukleofil adalah dua konsep penting dalam kimia organik yang membantu menggambarkan reaksi kimia antara akseptor elektron dan donor. Dua istilah ini diperkenalkan pada tahun 1933 oleh Christopher Kelk Ingold dan mereka berfungsi sebagai pengganti istilah kationoid dan anionoid yang diperkenalkan pada tahun 1925 oleh a.J. Lapworth.
Sejak itu, studi ekstensif dilakukan untuk memahami perbedaan antara elektrofil dan nukleofil. Artikel ini menghilangkan perbedaan perbedaan antara kedua konsep ini. Singkatnya, nukleofil adalah donor elektron sedangkan elektrofil adalah akseptor elektron.
Apa itu elektrofil?
Untuk memecah istilah, kata "elektro" berasal dari elektron dan kata Latin "phile" mengacu pada "cinta". Secara sederhana, itu berarti pencinta elektron. Ini adalah reagen yang ditandai dengan kepadatan elektron yang rendah dalam cangkang kelambu, dan, oleh karena itu, bereaksi dengan molekul, ion atau atom dengan kepadatan tinggi untuk membentuk ikatan kovalen. Ion hidrogen dalam asam dan metil-karbokasi adalah contoh zat elektrofilik. Mereka kekurangan elektron.
Elektrofil mudah terdeteksi dengan muatan positif atau muatan netral dengan orbital kosong (tidak memuaskan aturan oktet). Elektron bergerak dari area kepadatan tinggi ke yang dengan kepadatan rendah, dan tidak seperti muatan saling menarik. Teori ini menjelaskan daya tarik elektron oleh atom elektrofil yang kekurangan elektron, molekul atau ion. Menurut definisi, elektrofil secara bergantian disebut asam Lewis karena menerima elektron sejalan dengan definisi asam.
Reaksi dan senyawa di bawah ini menunjukkan contoh elektrofil:

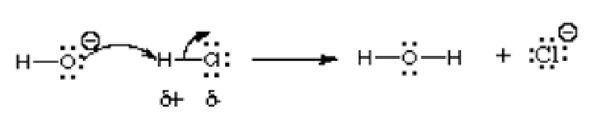
Dalam reaksi ini, ion hidroksida bereaksi dengan hidrogen klorida; Dengan demikian asam bereaksi dengan basa. Seperti yang ditunjukkan oleh panah, atom oksigen yang lebih elektronegatif menyumbangkan elektron ke atom hidrogen yang kekurangan elektron. Ini berbagi pasangan tunggal ke atom hidrogen yang memiliki muatan positif dalam senyawa hidrogen klorida karena lebih elektronegatif daripada hidrogen. Reaksi ini merupakan dasar dari banyak reaksi kimia organik, terutama reaksi Lewis Acid dan Lewis Basa. Contoh lain digambarkan dalam gambar berikut:
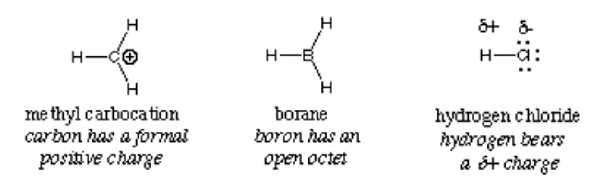
Secara umum, elektrofil diidentifikasi dengan muatan positif parsial seperti pada hidrogen klorida, muatan positif formal seperti pada metil karbokasi atau orbital kosong. Molekul netral terpolarisasi seperti asil halida, senyawa karbonil, dan alkil halida adalah contoh khas elektrofil.
Penting: Ion hidronium, meskipun memiliki muatan positif, tidak memenuhi syarat untuk diklasifikasikan sebagai elektrofil karena orbital kosong penuh di cangkang luarnya. Itu menghasilkan ion hidrogen dan air. Hal yang sama berlaku untuk ion amonium; itu tidak memiliki orbital kosong yang dapat menarik elektron. Akibatnya, ini bukan elektrofil.
Apa itu nukleofil?
Istilah ini dipecah menjadi kata "nukleo" yang mengacu pada nukleus dan kata Latin "phile" yang berarti mencintai. Itu berarti cinta nukleus. Nukleofil kaya akan elektron dan, sebagaimana demikian, menyumbangkan pasangan elektron untuk elektrofil untuk membentuk ikatan kovalen dalam reaksi kimia. Zat -zat ini paling baik diperhatikan dengan pasangan tunggal, ikatan PI dan muatan negatif. Ion amonia, iodida dan hidroksida adalah contoh zat nukleofil.
Menurut definisi, nukleofil secara bergantian disebut basis Lewis karena mereka semua menyumbangkan elektron dan menerima proton. Gambar di bawah ini menggambarkan contoh nukleofil:
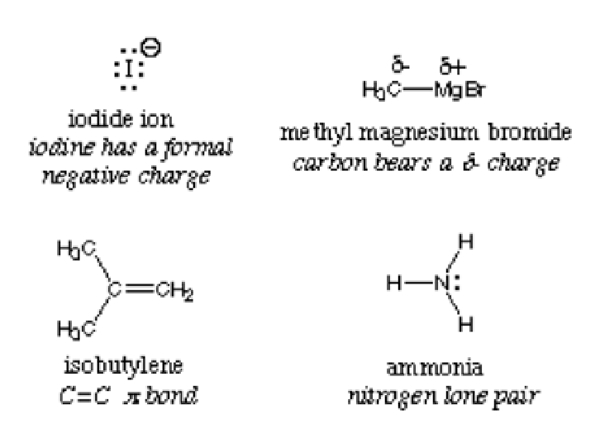
Pusat nukleofilik dalam suatu senyawa terdeteksi dengan atom yang paling elektronegatif. Pertimbangkan Ammonia NH3; Nitrogen lebih elektronegatif dan dengan demikian menarik elektron ke tengah. Senyawa ini memiliki kepadatan elektron yang tinggi dan, saat bereaksi dengan elektrofil, katakanlah air, ia menyumbangkan elektron. H2O Dapat bertindak baik sebagai elektrofil atau nukleofil tergantung pada senyawa atau molekul yang bereaksi dengan.
Pertimbangkan gambar di bawah ini:
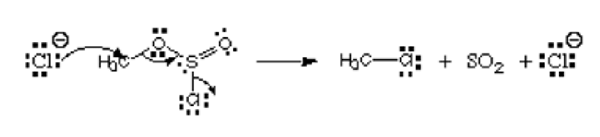
Dari gambar, atom pertama, ion klorida menyumbangkan satu -satunya pasangannya untuk karbon untuk membentuk ikatan kovalen. Ini memiliki muatan negatif dan menyumbangkan elektron, dan karenanya dianggap sebagai nukleofil. Atom klorin yang meninggalkan ester klorosulfit dinamai kelompok yang meninggalkan. Itu bukan elektrofil atau nukleofil.
Perbedaan utama antara elektrofil dan nukleofil
Definisi elektrofil dan nukleofil
Elektrofil adalah asam Lewis yang menerima elektron dari atom, ion atau molekul yang kaya elektron. Dengan menerima elektron, ia membentuk ikatan kovalen. Reagen ini sering diidentifikasi dengan muatan positif parsial, muatan positif formal atau atom netral, ion atau molekul yang tidak memenuhi aturan oktet. Nukleofil, di sisi lain, adalah atom, ion atau molekul yang memiliki kepadatan elektron yang tinggi. Ini menyumbangkan pasangan tunggal ke elektrofil untuk membentuk ikatan kovalen. Itu diidentifikasi oleh muatan positif dan elektron gratis dalam orbitnya.
Reaksi kimia elektrofil dan nukleofil
Nukleofil terlibat dalam substitusi nukleofilik dan penambahan sedangkan elektrofil terlibat dalam substitusi dan penambahan elektrofilik.
Identitas muatan dalam elektrofil dan nukleofil
Elektrofil dapat bermuatan netral atau positif sedangkan nukleofil dapat diisi secara netral atau negatif. Elektrofil menerima elektron sehingga disebut sebagai asam Lewis sedangkan nukleofil menyumbangkan elektron sehingga disebut sebagai basa Lewis.
Nukleofil ayat elektrofil: Bagan Perbandingan

Ringkasan nukleofil ayat elektrofil
- Elektrofil adalah atom yang kekurangan elektron ,, ion atau molekul sedangkan nukleofil adalah atom, molekul atau ion yang kaya elektron
- Elektrofil dapat bermuatan positif atau netral sementara nukleofil dapat diisi secara negatif atau netral
- Elektrofil disebut asam Lewis dan nukleofil disebut basa Lewis
- Elektrofil menerima elektron dan menyumbangkan proton sementara nukleofil menyumbangkan elektron dan menerima proton.

