Perbedaan antara basis lemah dan basis yang kuat
- 2500
- 118
- Virgil Hartmann IV
Beberapa definisi suatu basis digunakan dalam kimia kontemporer:
- Basis Arrhenius - Suatu zat yang meningkatkan konsentrasi anion hidroksida ketika dilarutkan dalam air;
- Basis Brønsted -Lowry - zat yang mengambil proton saat bereaksi dengan asam;
- Lewis Base - Suatu zat yang menghasilkan pasangan elektron zat lain, saat bereaksi dengan asam.
Yang paling banyak digunakan adalah definisi Brøndsted-Lowry.
Basis dalam arti luas termasuk tiga kelompok zat:
- Hidroksida logam yang larut dalam air: Naoh, CA (OH)2, dll.;
- Oksida atau hidroksida yang tidak larut dalam air yang dapat bereaksi dengan asam: feo, al (OH)3, dll.;
- Senyawa lain yang, ketika dilarutkan dalam air, berinteraksi dengannya dan melepaskan ion hidroksida: NH3, Ch3NH2, dll.
Beberapa sifat umum dari pangkalan adalah:
- Sabun atau sentuhan berlendir;
- Rasa pahit;
- Konduktivitas listrik;
- Reaksi kekerasan dengan zat yang dapat direduksi atau asam; kaustik pada bahan organik;
- Putar kertas lakmus merah biru.
APA ITU BASI LEBAT?
Basis lemah hanya sebagian terdisosiasi untuk memberikan ion dalam larutan.
Saat dasar terionisasi, ia meninggalkan OH- ion di belakang dengan mengambil ion hidrogen dari air. Solusi basis yang lemah memiliki h yang lebih tinggi+ konsentrasi daripada basis yang kuat.
Kebesaran larutan berair ditentukan oleh pH.
pH = -log10 [H+]
PH pangkalan lebih tinggi dari 7.3. Lemah secara kondisional dianggap sebagai pangkalan dengan pH di bawah 10.
Karena pangkalan adalah akseptor proton, pangkalan menerima oh- ion dari air. Basis yang lemah kurang sepenuhnya terprotonasi daripada basis yang lebih kuat dan, oleh karena itu memiliki H yang lebih tinggi+ konsentrasi dalam larutan. H lebih tinggi+ konsentrasi menghasilkan pH yang lebih rendah.
Dalam larutan air, basis ada dalam keseimbangan kimia. Posisi keseimbangan bervariasi tergantung pada kekuatan basis. Semakin lemah pangkalan, semakin jauh ke kiri digeser keseimbangan.
Posisi keseimbangan diukur dengan konstanta kesetimbangan (KB). Semakin banyak keseimbangan terletak di sebelah kiri, semakin rendah nilai untuk konstanta. Jadi basis yang lebih lemah memiliki konstanta kesetimbangan yang lebih rendah.
Basis yang lemah adalah elektrolit yang lemah.
Kemampuan solusi untuk melakukan listrik tergantung pada konsentrasi ion. Solusi dari basis yang lemah memiliki ion lebih sedikit daripada solusi yang kuat, dan oleh karena itu memiliki konduktivitas listrik yang lebih rendah.
Contoh basis yang lemah adalah:
- Alanine (c3H5HAI2NH2);
- Etilamin (c2H5NH2);
- Dimethylamine ((ch3)2NH);
- Methylamine (ch3NH2);
- Glisin (c2H3HAI2NH2);
- Trimethylamine ((ch3)3N);
- Hidrazin (n2H4).

Apa itu Basis yang Kuat?
Basis yang kuat sepenuhnya terdisosiasi untuk memberikan ion dalam larutan. Mereka memiliki pH antara 10 dan 14.
Basis yang kuat bersifat pedas terhadap jaringan hidup dan dapat menyebabkan dampak serius. Contoh umum basa yang kuat adalah hidroksida logam alkali dan alkali bumi.
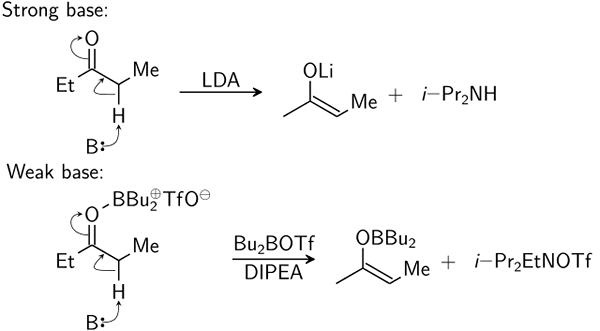
Basa yang sangat kuat dapat mendeprotonasi kelompok C-H asam yang lemah bahkan tanpa air.
Basis yang kuat memiliki konstanta keseimbangan yang lebih tinggi, dibandingkan dengan yang lebih lemah.
Basis yang kuat sangat reaktif. Mereka adalah elektrolit yang baik.
Kemampuan solusi untuk melakukan listrik tergantung pada konsentrasi ion. Basis yang kuat memiliki lebih banyak ion dalam larutan daripada yang lemah, sehingga memiliki konduktivitas listrik yang lebih tinggi.
Contoh basis yang kuat adalah:
- Strontium hidroksida (SR (OH)2);
- Barium hidroksida (BA (OH)2);
- Kalsium hidroksida (CA (OH)2);
- Natrium hidroksida (NaOH);
- Cesium hidroksida (CSOH);
- Kalium hidroksida (KOH).
Perbedaan antara basis lemah dan basis yang kuat
-
Definisi
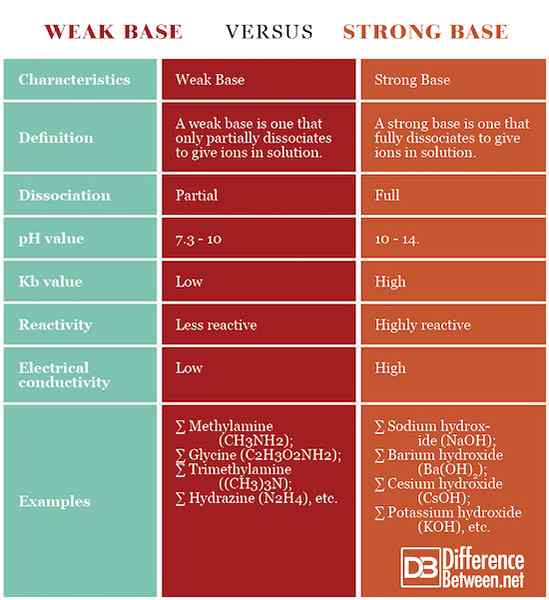
Basis yang lemah: Basis yang lemah adalah yang hanya sebagian memisahkan diri untuk memberikan ion dalam larutan.
Basis yang kuat: Basis yang kuat adalah yang sepenuhnya memisahkan diri untuk memberikan ion dalam larutan.
-
Disosiasi
Basis yang lemah: Basis lemah hanya sebagian memisahkan dalam larutan.
Basis yang kuat: Basis yang kuat sepenuhnya memisahkan dalam larutan.
-
nilai pH
Basis yang lemah: Basis yang lemah memiliki pH 7.3 - 10.
Basis yang kuat: Basis yang kuat memiliki pH 10 - 14.
-
Nilai kb
Basis yang lemah: Basis yang lemah memiliki konstanta kesetimbangan yang lebih rendah, dibandingkan dengan yang kuat.
Basis yang kuat: Basis yang kuat memiliki konstanta kesetimbangan yang lebih tinggi, dibandingkan dengan yang lemah.
-
Reaktivitas
Basis yang lemah: Basis yang lemah kurang reaktif daripada yang kuat.
Basis yang kuat: Basis yang kuat sangat reaktif.
-
Konduktivitas listrik
Basis yang lemah: Solusi dari basis yang lemah memiliki konduktivitas listrik yang lebih rendah daripada basis yang kuat ini.
Basis yang kuat: Solusi dari basis yang kuat memiliki konduktivitas listrik yang lebih tinggi daripada basis yang lemah ini.
-
Contoh
Basis yang lemah: Contoh basis yang lemah adalah methylamine (CH3NH2), glisin (c2H3HAI2NH2), trimethylamine ((ch3)3N), hidrazin (n2H4), dll.
Basis yang kuat: Contoh basa yang kuat adalah natrium hidroksida (NaOH), cesium hidroksida (CSOH), kalium hidroksida (KOH), barium hidroksida (BA (OH)2), dll.
Lemah vs. Basis Kuat: Bagan Perbandingan
Ringkasan VS Lemah. Dasar yang kuat
- Menurut definisi brønsted-lowry, basa adalah zat yang mengambil proton saat bereaksi dengan asam.
- Pangkalan memiliki sabun atau sentuhan berlendir dan rasa pahit. Mereka bereaksi dengan keras dengan zat yang dapat direduksi atau asam dan kaustik pada bahan organik.
- Basis yang lemah adalah yang hanya sebagian memisahkan diri untuk memberikan ion dalam larutan.
- Basis yang kuat adalah yang sepenuhnya memisahkan diri untuk memberikan ion dalam larutan.
- Basis lemah hanya sebagian terdisosiasi dalam larutan, sedangkan basis kuat terdisosiasi sepenuhnya dalam suatu larutan.
- Basis yang lemah memiliki pH 7.3 - 10, yang kuat memiliki pH 10 - 14.
- Basis yang lemah memiliki konstanta kesetimbangan yang lebih rendah, sedangkan basis yang kuat memiliki konstanta kesetimbangan yang lebih tinggi.
- Basis yang kuat sangat reaktif, sedangkan basis lemah kurang reaktif.
- Solusi dari basis yang lemah memiliki konduktivitas listrik yang lebih rendah daripada basis yang kuat ini.
- Contoh basis yang lemah adalah methylamine (CH3NH2), glisin (c2H3HAI2NH2), trimethylamine ((ch3)3N), hidrazin (n2H4), dll. Contoh basa yang kuat adalah natrium hidroksida (NaOH), barium hidroksida (BA (OH)2), cesium hidroksida (CSOH), kalium hidroksida (KOH), dll.

