Perbedaan antara molaritas dan molalitas
- 3964
- 301
- Marion Hegmann
Apa itu molaritas?
Molaritas dapat didefinisikan sebagai jumlah mol dari suatu zat (dikenal sebagai zat terlarut) yang dilarutkan dalam 1 liter suatu larutan (pelarut dan zat terlarut) digabungkan).
Formula untuk menghitung molaritas karena itu adalah sebagai berikut:
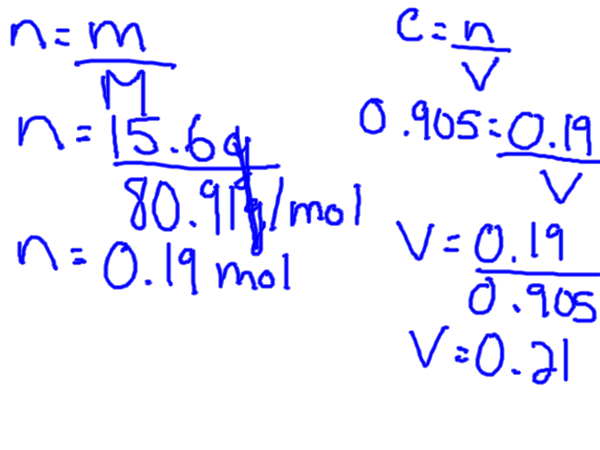
M = solusi zat terlarut / l mole
Molaritas juga biasanya disebut sebagai konsentrasi molar. Oleh karena itu ukuran konsentrasi molar berdasarkan volume cairan bahwa suatu zat dilarutkan. Penting untuk disadari bahwa volume dalam liter sehingga Anda mungkin harus mengonversi terlebih dahulu jika Anda memiliki volume dalam ML misalnya.
Untuk menyiapkan konsentrasi molar, seseorang menambahkan jumlah zat terlarut yang diketahui ke dalam labu volumetrik kemudian mengisi labu dengan cairan sampai tanda 1 liter tercapai.

Misalnya: seseorang dapat membuat konsentrasi gula molar tertentu. Berat gula pertama harus dikonversi menjadi tahi lalat dan kemudian air ditambahkan sampai 1 liter tercapai.
Untuk menghitung molaritas, Anda membutuhkan zat terlarut dalam tahi lalat, tetapi biasanya Anda akan memiliki berat zat terlarut tertentu yang berarti Anda pertama -tama perlu mengubah gram menjadi tahi lalat. Ini dapat dilakukan dengan menemukan massa molar zat terlarut dari tabel periodik.
Formula konsentrasi molar dapat diatur ulang untuk dipecahkan untuk volume dan mol.
Volume dipengaruhi oleh perubahan suhu atau tekanan. Misalnya, volume akan meningkat dengan meningkatnya suhu. Ini berarti bahwa akan ada beberapa pertanyaan tentang keakuratan di mana ada perubahan suhu.
Jika suhu berkurang cukup maka cairan dapat menyebabkan kontrak menyebabkan molaritas meningkat karena jumlah mol yang sama tetap tetapi akan ada lebih sedikit larutan.
Sebaliknya, jika suhu meningkat cukup maka cairan dapat berkembang menyebabkan molaritas berkurang karena jumlah mol yang sama tetap tetapi akan ada lebih banyak larutan yang ada.
Molaritas dapat digunakan untuk menghitung konsentrasi zat yang telah diencerkan.
Molaritas dapat digunakan saat presisi yang tepat tidak diperlukan. Namun dipengaruhi oleh perubahan suhu karena merupakan pengukuran volumetrik, jadi dalam beberapa kasus mungkin tidak sesuai untuk digunakan.
Molaritas dan molalitas bisa sama dalam beberapa kasus. Misalnya 1 liter air memiliki berat 1 kg.
Apa itu molalitas?
Molalitas dapat didefinisikan sebagai jumlah mol zat (dikenal sebagai zat terlarut) yang ditemukan dalam massa pelarut tertentu yang diberikan dalam kg, bahwa ia dilarutkan dalam.
Rumus untuk menghitung molalitas adalah :
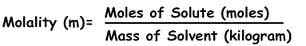
m = mol solute / kg pelarut
Molalitas juga disebut sebagai konsentrasi molal.
Contoh membuat konsentrasi molal adalah dengan berat sejumlah gula misalnya. Ini kemudian perlu dikonversi menjadi jumlah tahi lalat menggunakan massa molekul gula. Gelas air kemudian ditimbang dan air ditambahkan ke gelas sampai beratnya 1 kg.
Gula kemudian ditambahkan ke gelas air dan larut.
Keuntungan dari molalitas dibandingkan molaritas adalah tidak terpengaruh oleh perubahan suhu dan tekanan karena dihitung berdasarkan massa dan bukan volume. Massa pelarut tidak terpengaruh oleh suhu dalam cara volume suatu zat adalah, oleh karena itu molalitas adalah ukuran konsentrasi yang lebih akurat daripada molaritas.
Dalam kasus air molaritas dan molalitas mungkin sama karena 1 liter air memiliki berat 1 kg, namun ini mungkin tidak terjadi dengan semua cairan.
Ini berarti bahwa molalitas perlu digunakan saat sifat koligatif terkait.
Molalitas lebih akurat dan memberikan ketepatan konsentrasi yang lebih besar tetapi membutuhkan waktu lebih lama untuk mempersiapkan karena zat terlarut harus ditambahkan ke berat pelarut. Jika pelarutnya cair maka ini harus ditimbang.
Ini dapat dilakukan dengan menggunakan sistem gravimetri dan keseimbangan analitik untuk menimbang pelarut.
Apa perbedaan antara molaritas dan molalitas?
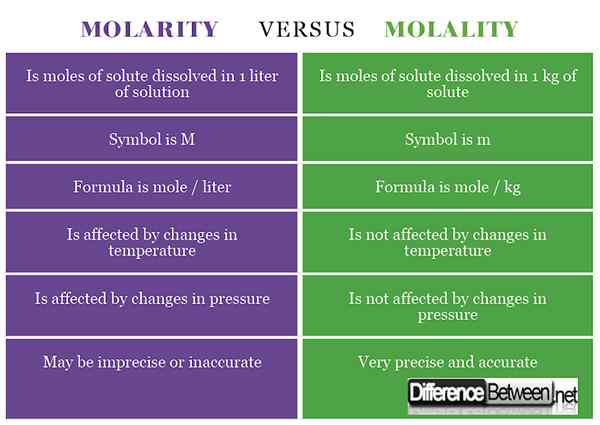
1) Molaritas adalah konsentrasi suatu zat yang dihitung sebagai jumlah mol zat terlarut yang dilarutkan dalam 1 liter larutan sementara molalitas adalah konsentrasi zat yang dihitung sebagai jumlah mol zat terlarut yang ditemukan dalam 1 kg pelarut.
2) Simbol molaritas adalah m, sedangkan untuk molalitas adalah m (kadang -kadang ditulis sebagai -m atau M untuk membedakannya dari massa).
3) Formula untuk molaritas adalah mol / liter sedangkan rumus untuk molalitas adalah mol / kg.
4) Molaritas dipengaruhi oleh perubahan suhu sementara molalitas tidak terpengaruh oleh perubahan suhu.
5) Molaritas dipengaruhi oleh perubahan tekanan sementara molalitas tidak terpengaruh oleh perubahan tekanan.
6) Molaritas dapat menghasilkan konsentrasi yang tidak tepat dan tidak akurat, sedangkan molalitas menghasilkan pengukuran konsentrasi yang tepat akurat.
Tabel yang membandingkan molaritas dan molalitas
Ringkasan molaritas dan molalitas
- Baik molaritas dan molalitas keduanya dapat digunakan untuk mengukur konsentrasi.
- Molaritas didefinisikan sebagai jumlah mol dari zat terlarut yang dilarutkan dalam 1 liter larutan.
- Molalitas didefinisikan sebagai jumlah mol dari zat terlarut yang dilarutkan dalam 1 kg pelarut.
- Molalitas adalah cara yang lebih tepat dan akurat untuk membuat konsentrasi tertentu karena tidak terpengaruh oleh perubahan suhu dan tekanan.
- Molaritas melibatkan cairan yang berarti konsentrasi dapat berubah. Ini karena volume menjadi cairan dapat berubah dengan perubahan suhu dan tekanan.
- « Perbedaan antara kecacatan intelektual dan kecacatan perkembangan
- Perbedaan antara Groupby dan Orderby »

