Perbedaan antara geometri elektron dan geometri molekuler
- 2597
- 282
- Grant Zieme
Kimia adalah studi tentang materi dan berurusan dengan banyak cara satu jenis materi dapat diubah menjadi jenis lain. Diketahui bahwa semua materi terbuat dari satu atau lebih dari sekitar seratus jenis atom yang berbeda. Semua atom terdiri dari tiga partikel mendasar - proton, elektron, dan neutron. Molekul terdiri dari sekelompok dua atau lebih atom yang disatukan dalam pola geometris yang pasti. Ketika dua atau lebih atom sangat disatukan untuk membentuk molekul, ada ikatan kimia antara masing -masing atom dan tetangganya yang dekat. Bentuk molekul menyampaikan banyak informasi dan langkah pertama untuk memahami kimia molekul adalah untuk mengetahui geometrinya.
Geometri molekuler hanya mengacu pada susunan atom tiga dimensi yang merupakan molekul. Istilah struktur agak digunakan dalam arti untuk menunjukkan hanya konektivitas atom. Bentuk molekul ditentukan dalam hal jarak antara inti atom yang terikat bersama. Geometri molekul ditentukan oleh Teori Repulsi Tasian Elektron (VESPR) valensi- model yang digunakan untuk menentukan bentuk umum molekul berdasarkan jumlah pasangan elektron di sekitar atom pusat. Geometri molekul diberikan baik sebagai geometri elektron atau geometri molekuler.

Apa itu geometri elektron?
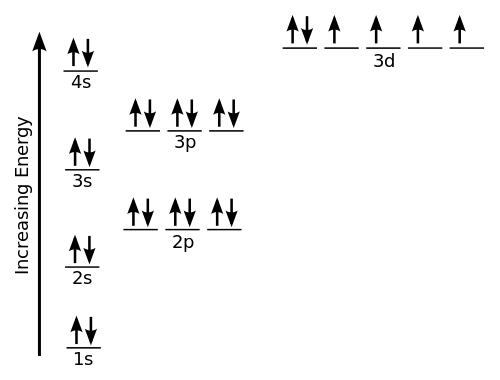
Istilah geometri elektron mengacu pada nama geometri pasangan elektron/kelompok/domain pada atom pusat, apakah mereka mengikat elektron atau elektron yang tidak mengikat. Pasangan elektron didefinisikan sebagai elektron berpasangan atau ikatan, pasangan tunggal, atau kadang -kadang elektron tidak berpasangan. Karena elektron selalu dalam gerakan konstan dan jalurnya tidak dapat didefinisikan secara tepat, pengaturan elektron dalam suatu molekul dijelaskan dalam hal distribusi kerapatan elektron. Mari kita ambil contoh metana, formula kimianya adalah ch4. Di sini, atom pusat adalah karbon dengan 4 elektron valensi dan 4 hidrogen berbagi elektron dengan 1 karbon untuk membentuk 4 ikatan kovalen. Ini berarti ada total 8 elektron di sekitar karbon dan tidak ada ikatan tunggal, jadi jumlah pasangan tunggal di sini adalah 0. Itu menunjukkan ch4 adalah geometri tetrahedral.
Apa itu geometri molekuler?
Geometri molekul digunakan untuk menentukan bentuk molekul. Ini hanya mengacu pada pengaturan tiga dimensi atau struktur atom dalam molekul. Memahami geometri molekuler suatu senyawa membantu menentukan reaktivitas, polaritas, warna, fase materi, dan magnetisme. Geometri molekul biasanya dijelaskan dalam hal panjang ikatan, sudut ikatan, dan sudut torsional. Untuk molekul kecil, formula molekul dan tabel panjang dan sudut ikatan standar mungkin semua yang diperlukan untuk menentukan geometri molekul. Tidak seperti geometri elektron, ini diprediksi dengan hanya mempertimbangkan pasangan elektron. Mari kita ambil contoh air (h2HAI). Di sini, oksigen (O) adalah atom pusat dengan 6 elektron valensi sehingga membutuhkan 2 elektron lebih dari 2 atom hidrogen untuk menyelesaikan oktetnya. Jadi ada 4 kelompok elektron yang diatur dalam bentuk tetrahedral. Ada juga 2 pasangan ikatan tunggal, jadi bentuk yang dihasilkan bengkok.
Perbedaan antara geometri elektron dan geometri molekuler
Terminologi untuk geometri elektron dan geometri molekuler
Istilah geometri elektron mengacu pada nama geometri pasangan elektron/kelompok/domain pada atom pusat, apakah mereka mengikat elektron atau elektron yang tidak mengikat. Ini membantu memahami bagaimana berbagai kelompok elektron diatur dalam molekul. Geometri molekul, di sisi lain, menentukan bentuk molekul dan itu adalah struktur tiga dimensi atom dalam molekul. Ini membantu memahami seluruh atom dan pengaturannya.
Geometri
Geometri molekul ditentukan berdasarkan hanya pasangan elektron ikatan tetapi bukan jumlah pasangan elektron. Itu adalah bentuk tiga dimensi yang ditempati molekul di luar angkasa. Geometri molekuler juga didefinisikan sebagai posisi inti atom dalam molekul. Geometri elektron molekul, di sisi lain, ditentukan berdasarkan kedua pasangan elektron ikatan dan pasangan elektron tunggal. Geometri elektron dapat ditentukan dengan menggunakan teori VESPR.
Contoh geometri elektron dan geometri molekuler
Salah satu dari banyak contoh geometri elektron tetrahedral adalah amonia (NH3). Atom pusat di sini adalah N dan empat pasangan elektron didistribusikan dalam bentuk tetrahedron dengan hanya satu pasangan elektron tunggal. Dengan demikian, geometri elektron NH3 adalah tetrahedral. Namun, geometri molekulnya adalah trigonal piramidal karena sudut ikatan 107 derajat karena atom hidrogen ditolak oleh pasangan elektron yang satu -satunya di sekitar nitrogen. Demikian pula, geometri molekul air (h2O) bengkok karena ada 2 pasangan ikatan tunggal.
Geometri elektron vs. Geometri Molekuler: Bagan Perbandingan

Ringkasan Geometri Elektron VS. Geometri molekuler
Baik geometri elektron dan geometri molekuler mengikuti model tolakan-tolol-t-pasangan valensi (VESPR) untuk menentukan bentuk umum molekul berdasarkan jumlah pasangan elektron di sekitar atom pusat. Namun, geometri molekuler ditentukan semata -mata berdasarkan pasangan ikatan elektron, bukan jumlah pasangan elektron, sedangkan geometri elektron ditentukan berdasarkan kedua pasangan elektron ikatan dan pasangan elektron sendirian. Ketika tidak ada pasangan elektron yang ada dalam molekul, geometri elektron sama dengan bentuk molekul. Seperti yang kami katakan, bentuk molekul mengatakan banyak tentang hal itu dan langkah pertama untuk memahami kimia molekul adalah untuk menentukan geometrinya.

