Perbedaan antara koloid dan suspensi
- 3608
- 15
- Rodney Hegmann
Sistem dispersi terdiri dari dua atau lebih senyawa kimia atau zat sederhana, yang disebut komponen sistem, didistribusikan satu sama lain. Mereka membentuk:
- Fase tersebar - zat yang tersebar;
- Media kontinu - zat di mana fase tersebar didistribusikan.
Tergantung pada ukuran partikel fase dispersi ada:
- Sistem dispersi heterogen (kasar) - partikelnya lebih besar dari 100 nm:
- Suspensi - komponen cair dan padat;
- Emulsi - dua komponen cair;
- Aerosol - Media dispersi adalah gas.
- Koloid - Ukuran partikel adalah antara 1 dan 100 nm;
- Solusi Nyata - Ukuran partikel kurang dari 1 nm.

Apa itu koloid?
Solusi air dari banyak zat (gula, dll.), dengan mudah melewati hambatan tumbuhan atau semipermeabel, sementara yang lain seperti gelatin tidak melewatinya. Zat pertama disebut kristaloid, dan yang kedua disebut koloid.
Bergantung pada bagaimana partikel -partikel fase terdispersi mengacu pada media, sistem koloid adalah:
- Lyophilic - Menyerap sejumlah besar molekul dari media dispersi (gelatin, sabun, Fe (OH)3, Al (oh)3);
- Lyophobic - Jangan mengikat atau mengikat dengan sejumlah kecil molekul dari media dispersi (garam logam tertentu, sulfida logam yang tidak larut dengan buruk, dll.).
Tergantung pada struktur partikel koloid, sistem koloid dibagi lagi menjadi:
- Terkait (misel) - partikel adalah kelompok atom, ion atau molekul (e.G. natrium klorida dalam benzena);
- Molekuler - Partikel adalah molekul dari suatu senyawa yang memiliki massa molekul tinggi (E.G. pati).
Tergantung pada sifat medium, koloidnya adalah:
- Hydrosols - pelarut adalah air;
- Benzenosols - pelarutnya adalah benzena;
- Etherosols - pelarutnya adalah eter dll.
Sifat optik koloid dimanifestasikan sebagai pewarnaan, opalescence, dan efek tindal. Mereka disebabkan oleh perbedaan penyerapan dan dispersi cahaya dari partikel koloid.
Partikel koloid lebih besar dan lebih berat dari ion dan sebagian besar molekul, sehingga difusi dan tekanan osmotiknya rendah.
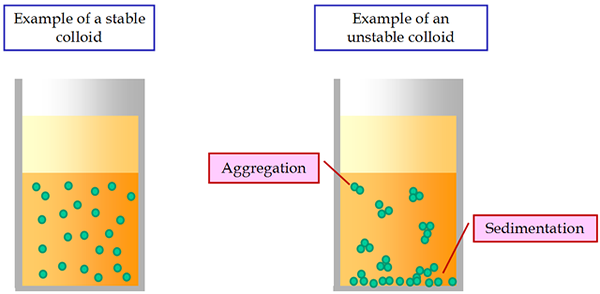
Properti Kinetik Koloid Koloid adalah Gerakan Brown. Sistem koloid kurang stabil dibandingkan dengan solusi biasa. Di bawah arus listrik yang konstan, semua partikel koloid bergerak ke elektroda bermuatan berlawanan yang sesuai. Fenomena ini disebut elektroforesis.
Sol koloid molekul diperoleh secara analog dengan larutan yang sebenarnya. Setelah kontak fase dispersi melarutkan secara spontan dalam medium tersebar. SOL dari koloid terkait diperoleh dengan berbagai metode dispersi dan kondensasi.
- Metode dispersi - dispersi material dengan ukuran partikel koloid dengan adanya media dispersi;
- Metode kondensasi - kondensasi (pengelompokan) molekul individu, atom atau ion menjadi partikel dengan ukuran koloid.
Apa itu suspensi?
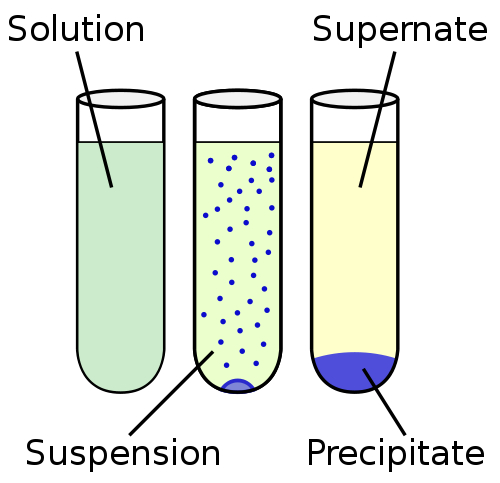
Suspensi adalah cairan heterogen, yang mengandung partikel padat yang tidak larut yang cukup besar untuk diselesaikan tetapi untuk beberapa waktu hadir di seluruh volume matriks cairan. Partikel -partikelnya lebih besar dari 100 nm.
Klasifikasi suspensi didasarkan pada fase terdispersi dan media dispersi.
Suspensi lebih dekat dengan kelilin ketidakmampuan dalam kontinum kelarutan. Di ujung lain dari kontinum kelarutan adalah solusinya, di mana partikel -partikel sepenuhnya dicampur dan tidak ada fase padat yang diamati. Kontinum kelarutan umumnya diatur dalam urutan: ketidakmampuan, sedimentasi, suspensi, koloid dan larutan dan larutan.
Fase padat dari suspensi tersebar dalam fase cair dengan proses pengadukan mekanis dengan menggunakan agen inert atau aktif lemah yang digunakan sebagai agen suspensi. Tidak seperti koloid, suspensi menetap seiring waktu. Contoh suspensi pengendapan yang cepat adalah pasir dan air.
Properti khas dari suspensi adalah ketidakhomogenan optiknya, yang diekspresikan oleh kekeruhan. Turbiditas adalah tanda eksternal integral dari suspensi dan ditentukan oleh adanya partikel tidak larut yang tidak dapat ditembus dengan cahaya. Tingkat kekeruhan suspensi berbeda. Ini ditentukan oleh konsentrasi fase tersuspensi dan tingkat dispersi (ukuran partikel).
Salah satu fitur paling penting dari suspensi adalah ketidakstabilan sedimentasi mereka. Itu diekspresikan dalam penyelesaian partikel tersuspensi yang tak terhindarkan di bawah pengaruh gravitasi. Partikel dapat mengendap sendiri, tanpa saling menempel. Dalam hal ini ada stabilitas agregatif suspensi.
Jika partikel pengendapan tetap bersatu di bawah pengaruh kekuatan molekuler kohesi dan membentuk agregat, maka ada ketidakstabilan agregatif suspensi. Dengan demikian, suspensi yang tidak stabil secara sedimentasi dapat stabil secara agregatif atau tidak stabil.
Kadang -kadang dalam suspensi koagulasi, serpihan besar terbentuk yang kurang dibasahi oleh media dispersi dan mengapung ke permukaan. Fenomena ini disebut flokulasi.
Ketidakstabilan sedimentasi suspensi dalam praktiknya menyebabkan gangguan secara bertahap dari komposisi seragam sebelum deposisi lengkap dari fase yang tidak larut.
Ada juga suspensi, memiliki kemampuan untuk tetap dalam keadaan yang ditangguhkan untuk waktu yang lama. Mereka disebut suspensi yang stabil.
Suspensi diperoleh dengan berbagai metode dispersi dan kondensasi.
Perbedaan antara koloid dan suspensi
-
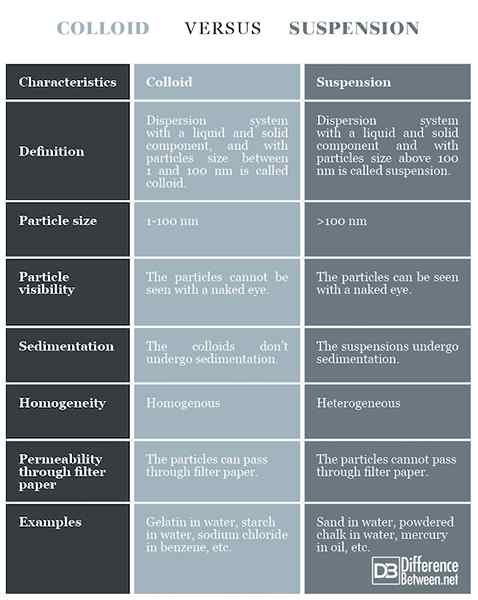
Definisi
Koloid: Sistem dispersi dengan komponen cair dan padat, dengan ukuran partikel antara 1 dan 100 nm disebut koloid.
Penangguhan: Sistem dispersi dengan komponen cair dan padat, dengan ukuran partikel di atas 100 nm disebut suspensi.
-
Ukuran partikel
Koloid: Ukuran partikel adalah 1-100 nm.
Penangguhan: Ukuran partikel di atas 100 nm.
-
Visibilitas partikel
Koloid: Partikel -partikel dalam koloid tidak dapat dilihat dengan mata telanjang.
Penangguhan: Partikel -partikel dalam suspensi dapat dilihat dengan mata telanjang.
-
Pengendapan
Koloid: Koloid tidak mengalami sedimentasi.
Penangguhan: Suspensi mengalami sedimentasi.
-
Homogenitas
Koloid: Koloid relatif homogen.
Penangguhan: Suspensi heterogen.
-
Permeabilitas melalui kertas saring
Koloid: Partikel koloid dapat melewati kertas saring.
Penangguhan: Partikel suspensi tidak dapat melewati kertas saring.
-
Contoh
Koloid: Gelatin dalam air, pati dalam air, natrium klorida dalam benzena, dll.
Penangguhan: Pasir dalam air, kapur bubuk dalam air, merkuri dalam minyak, dll.
Bagan Perbandingan Koloid dan Suspensi
Ringkasan koloid dan suspensi
- Sistem dispersi terdiri dari dua atau lebih senyawa kimia atau zat sederhana, yang disebut komponen sistem, didistribusikan satu sama lain. Mereka membentuk fase yang tersebar dan media kontinu.
- Sistem dispersi dengan komponen cair dan padat, dengan ukuran partikel antara 1 dan 100 nm disebut koloid.
- Sistem dispersi dengan komponen cair dan padat, dengan ukuran partikel di atas 100 nm disebut suspensi.
- Partikel -partikel dalam koloid tidak dapat dilihat dengan mata telanjang, sedangkan partikel dalam suspensi dapat dilihat dengan mata telanjang.
- Koloid tidak mengalami sedimentasi, sementara suspensi mengalami sedimentasi.
- Koloid relatif homogen, sedangkan suspensi heterogen.
- Partikel koloid dapat melewati kertas filter, sedangkan partikel suspensi tidak bisa.
- Contoh koloid adalah gelatin dalam air, pati dalam air, natrium klorida dalam benzena, dll. Contoh suspensi adalah pasir dalam air, kapur bubuk dalam air, merkuri dalam minyak, dll.

