Perbedaan antara asam dan basa
- 1803
- 227
- Isaac Veum DDS
 Asam vs basa
Asam vs basa
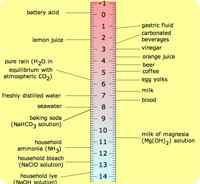
Asam dan basa adalah istilah kimia yang merujuk pada potensi berbagai zat kimia. Asam, dalam kimia, biasanya cairan, yang mengandung hidrogen dan memiliki nilai pH kurang dari tujuh. Hydroen dapat diganti dengan logam untuk membentuk garam. Nilai pH basa selalu lebih dari 7 dan biasanya bergabung dengan asam untuk membentuk garam. Nilai pH adalah skala untuk menentukan keasaman atau alkalinitas suatu zat.
Asam dan basa juga dapat digabungkan untuk membentuk air, air garam dan garam ionik. Berdasarkan diferensiasi ini, asam adalah konduktur listrik yang baik karena mereka memiliki ion H+ sementara basa tidak dan lebih licin dalam tekstur. Basis berisi OH-ion. Basis, saat melarutkan dalam air, lepaskan ion hidroksida yang merupakan satu hidrogen dan satu atom oksigen masing -masing dengan muatan negatif. Di sisi lain, asam hanya melepaskan ion hidrogen.
Asam dan basa adalah polaritas yang berlawanan dan oleh karena itu, mereka saling menetralkan. Asam dan basa bereaksi dengan zat lain secara kaustik. Juga, ketika datang ke interaksi kimia, asam berfungsi sebagai donator proton sementara basa berfungsi sebagai akseptor proton.
Baik asam dan basa dapat diklasifikasikan sebagai lemah atau kuat. Dalam kasus asam dan basa lemah, hasil konjugat kuat tetapi asam atau basa lemah tidak terpisah dengan benar dalam air. Namun, asam dan basa kuat mengelola disosiasi hampir lengkap dalam air meskipun asam konjugat atau basa lemahnya.
Mengenai sifat fisik, asam adalah asam dalam rasa dan dapat membakar atau menghancurkan zat yang bersentuhan dengan mereka. Mereka meninggalkan efek menyengat pada selaput lendir. Basis, di sisi lain, rasanya pahit dan memiliki tekstur sabun atau licin. Baik asam dan basa bisa berbahaya bagi tubuh manusia jika nilai pH tinggi. Nilai pH asam lebih rendah dari 7 dan nilai pH basa lebih tinggi dari 7. Air yang baru disuling memiliki nilai pH 7.

