Senyawa vs. Elemen
- 5147
- 1627
- Isaac Veum DDS
Elemen Dan senyawa adalah zat kimia murni yang ditemukan di alam. Itu Perbedaan antara elemen dan senyawa adalah bahwa suatu elemen adalah zat yang terbuat dari jenis atom yang sama, sedangkan senyawa terbuat dari elemen yang berbeda dalam proporsi yang pasti. Contoh elemen termasuk zat besi, tembaga, hidrogen dan oksigen. Contoh senyawa termasuk air (h2O) dan garam (natrium klorida - NaCl).
Elemen terdaftar sesuai dengan nomor atomnya di tabel periodik. Di antara 117 elemen yang diketahui, 94 secara alami terjadi seperti karbon, oksigen, hidrogen dll. 22 diproduksi secara artifisial telah mengalami perubahan radioaktif. Alasan untuk ini adalah ketidakstabilan mereka karena mereka menjalani peluruhan radioaktif selama periode waktu tertentu sehingga memunculkan unsur -unsur baru selama proses seperti uranium, thorium, bismut, dll. Elemen bergabung dalam rasio tetap dan menimbulkan senyawa yang stabil karena ikatan kimia yang memfasilitasi pembentukan senyawa.
Grafik perbandingan
| Menggabungkan | Elemen | |
|---|---|---|
| Definisi | Senyawa mengandung atom dari berbagai elemen yang secara kimia digabungkan bersama dalam rasio tetap. | Elemen adalah zat kimia murni yang terbuat dari jenis atom yang sama. |
| Komposisi | Senyawa mengandung elemen yang berbeda dalam rasio tetap yang disusun dengan cara yang ditentukan melalui ikatan kimia. Mereka hanya mengandung satu jenis molekul. Elemen yang menyusun senyawa digabungkan secara kimia. | Elemen hanya berisi satu jenis atom. Setiap atom memiliki nomor atom yang sama i.e., jumlah proton yang sama dalam nukleus mereka. |
| Kemampuan untuk mogok | Senyawa dapat dipisahkan menjadi zat yang lebih sederhana dengan metode/reaksi kimia. | Elemen tidak dapat dipecah menjadi zat yang lebih sederhana dengan reaksi kimia. |
| Perwakilan | Senyawa diwakili menggunakan rumus kimianya yang mewakili simbol elemen konstituennya dan jumlah atom dari setiap elemen dalam satu molekul senyawa. | Elemen diwakili menggunakan simbol. |
| Tipe | Jumlah senyawa kimia yang besar, hampir tidak terbatas. Senyawa diklasifikasikan ke dalam senyawa molekul, senyawa ionik, senyawa intermetalik dan kompleks. | Ada sekitar 117 elemen yang telah diamati. Dapat diklasifikasikan sebagai logam, non-logam atau metaloid. |
| Contoh | Air (H2O), natrium klorida (NaCl), natrium bikarbonat (NAHCO3) dan asam klorida (HCl) adalah contoh senyawa. | Hidrogen (H), oksigen (O), natrium (Na), klorin (CL), karbon (C), besi (Fe), tembaga (Cu), perak (Ag), dan emas (Au) adalah contoh elemen. |
Perbedaan properti
Elemen dibedakan dengan nama, simbol, nomor atom, titik leleh, titik didih, energi kepadatan dan ionisasi. Dalam tabel periodik, elemen disusun sesuai dengan nomor atomnya dan mereka dikelompokkan sesuai dengan sifat kimia yang sama dan digambarkan oleh simbolnya.
- Nomor atom - Nomor atom dilambangkan dengan surat itu Z dan jumlah proton yang ada dalam inti atom elemen. Untuk e.G. Karbon memiliki 6 proton dalam nukleusnya dan untuk karbon, z = 6. Jumlah proton juga menunjukkan muatan listrik atau jumlah elektron yang ada dalam nukleus yang menentukan sifat kimia elemen.
- Massa atom - surat A menunjukkan massa atom dari elemen yang merupakan jumlah total proton dan neutron dalam inti atom elemen. Isotop dari elemen yang sama berbeda dalam massa atomnya.
- Isotop - Isotop suatu unsur memiliki jumlah proton yang sama dalam nukleus mereka tetapi berbeda dalam jumlah neutron. Elemen yang terjadi secara alami memiliki lebih dari satu isotop yang stabil. Dengan demikian isotop memiliki sifat kimia yang sama (karena jumlah proton yang sama) tetapi sifat nuklir yang berbeda (karena jumlah neutron yang berbeda). Untuk e.G. Karbon memiliki tiga isotop, karbon - 12, karbon -13 dan karbon - 14.
- Alotrop - Atom -atom suatu elemen dapat membentuk ikatan satu sama lain dalam lebih dari satu cara yang mengarah pada perbedaan sifat kimianya. Untuk e.G. Karbon berikatan dalam tetrahedron untuk membentuk berlian dan lapisan segi enam karbon membentuk grafit.
Senyawa terdiri dari berbagai elemen dalam proporsi tetap. Sebagai contoh, 1 atom natrium (Na) bergabung dengan 1 atom klorin (cl) untuk membentuk satu molekul senyawa natrium klorida (NaCl). Elemen dalam senyawa tidak selalu mempertahankan sifat aslinya dan tidak dapat dipisahkan dengan cara fisik. Kombinasi elemen difasilitasi oleh valensi mereka. Valensi didefinisikan sebagai jumlah atom hidrogen yang diperlukan yang dapat digabungkan dengan atom elemen yang membentuk senyawa. Sebagian besar senyawa dapat ada sebagai padatan (suhu yang cukup rendah) dan dapat didekomposisi dengan aplikasi panas. Terkadang elemen asing terperangkap di dalam struktur kristal senyawa yang memberi mereka struktur yang tidak homogen. Senyawa digambarkan oleh formula kimianya yang mengikuti sistem bukit di mana atom karbon terdaftar terlebih dahulu, diikuti oleh atom hidrogen setelah itu elemen terdaftar dalam urutan abjad.
Memvisualisasikan perbedaan
Gambar ini menunjukkan perbedaan antara elemen dan senyawa pada tingkat atom. Elemen hanya memiliki 1 jenis atom; senyawa memiliki lebih dari 1. Elemen dan senyawa keduanya zat; Mereka berbeda dari campuran di mana zat yang berbeda bercampur bersama tetapi tidak melalui ikatan atom.
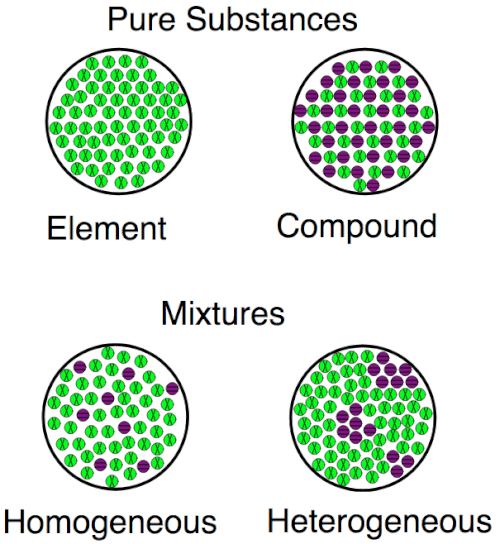 Visualisasi untuk perbedaan antara elemen, senyawa dan campuran, baik homogen maupun heterogen.
Visualisasi untuk perbedaan antara elemen, senyawa dan campuran, baik homogen maupun heterogen. Sejarah Elemen dan Senyawa
Elemen awalnya digunakan sebagai referensi ke keadaan materi seperti cairan, gas, udara, padatan dll. Tradisi India, Jepang dan Yunani merujuk pada lima elemen yaitu, udara, air, bumi, api dan eter. Aristoteles mengkonseptualisasikan elemen kelima baru yang disebut 'Kekayaan' - yang tampaknya membentuk surga. Ketika penelitian berlanjut, banyak ilmuwan terkemuka membuka jalan bagi pemahaman dan deskripsi elemen saat ini. Di antara mereka, karya Robert Boyle, Antoine Lavoisier, Dmitri Mendeleev sangat terkenal. Lavoisier adalah yang pertama membuat daftar elemen kimia dan Mendeleev adalah yang pertama mengatur elemen sesuai dengan nomor atom mereka di tabel periodik. Definisi elemen terkini diberikan oleh studi yang dilakukan oleh Henry Moseley yang menyatakan bahwa jumlah atom atom diungkapkan secara fisik dengan muatan nuklirnya.
Sebelum tahun 1800 -an penggunaan istilah menggabungkan bisa juga berarti campuran. Pada abad ke -19 makna senyawa dapat dibedakan dari campuran. Alkemis seperti Joseph Louis Proust, Dalton dan Berthollet dan studi mereka tentang berbagai senyawa telah memberikan kimia modern definisi senyawa saat ini. Karya Proust ditunjukkan kepada dunia kimia bahwa senyawa dibuat komposisi konstan dari masing -masing elemen.
Nomor CAS
Setiap zat kimia diidentifikasi oleh pengidentifikasi numerik yang unik - nomor CAS (Layanan Abstrak Kimia). Karenanya setiap senyawa dan elemen kimia memiliki nomor CAS. Ini membuat pencarian basis data untuk elemen dan senyawa lebih nyaman.

