Butana vs. Metana

- 1992
- 164
- Richard Hegmann MD
Butana Dan metana adalah hidrokarbon dari senyawa keluarga kimia yang sama yang dikenal sebagai alkana. Mereka adalah komponen gas alam dan ekstraksi minyak.
Grafik perbandingan
Perbedaan - Persamaan -| Butana | Metana | |
|---|---|---|
| nomor CAS | 106-97-8 y | 74-82-8 y |
| Pubchem | 7843 | 297 |
| Chemspider | 7555 | 291 |
| Senyum | CCCC | C |
| Inci | 1/C4H10/C1-3-4-2/H3-4H2,1-2H3 | 1/CH4/H1H4 |
| Formula molekul | C4H10 | CH4 |
| Masa molar | 58.12 g mol - 1 | 16.042 g/mol |
| Penampilan | Gas tidak berwarna | Gas tidak berwarna |
| Kepadatan | 2.48 kg/m3, gas (15 ° C, 1 atm) 600 kg/m3, cairan (0 ° C, 1 atm) | 0.717 kg/m3, gas 415 kg/m3 cairan |
| Titik lebur | −138.4 ° C (135.4 k) | -182.5 ° C, 91 K, -297 ° F |
| Titik didih | −0.5 ° C (272.6 K) | -161.6 ° C, 112 K, -259 ° F |
| Kelarutan dalam air | 6.1 mg/100 ml (20 ° C) | 35 mg/L (17 ° C) |
| MSDS | MSD eksternal | MSD eksternal |
| NFPA 704 | 4 1 0 | 4 1 0 |
| Titik nyala | −60 ° C | -188 ° C |
| Batas eksplosif | 1.8 - 8.4% | 5 - 15% |
| Alkana terkait | Propana; Pentane | Ethane, propana |
| Senyawa terkait | Isobutane; Cyclobutane | Metanol, kloroman, asam format, formaldehida, silan |
| Struktur dan sifat | n, εr, dll. | n, εr, dll. |
| Data termodinamika | Perilaku fase padat, cair, gas | Perilaku fase padat, cair, gas |
| Data spektral | UV, IR, NMR, MS | UV, IR, NMR, MS |
| Penggunaan | Butana digunakan dalam pendingin, pemecah rokok, pemanasan sebagai LPG atau gas minyak cair. | Metana adalah sumber energi yang digunakan untuk tujuan pemanasan. |
| Efek berbahaya | Butana dapat menyebabkan sesak napas dan fibrilasi ventrikel. | Metana adalah gas rumah kaca yang kuat. Itu dapat membentuk campuran eksplosif dengan udara. |
| Sumber | Minyak mentah, gas alam. | Bidang gas alam, produksi biogas, metana atmosfer, metana terestrial ekstra. |
Formula kimia dan struktur molekul metana vs butana
Butana adalah c4H10 Sedangkan metana memiliki formula kimia - ch4. Dengan demikian ada empat atom hidrogen dalam molekul metana sementara ada sepuluh atom hidrogen dalam molekul butana. Molekul metana membentuk struktur tetrahedral sementara butana adalah struktur linier.
 Molekul metana - rendering 3D
Molekul metana - rendering 3D 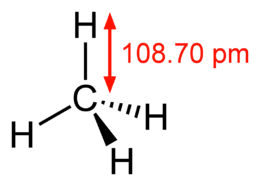 Molekul metana - Formula struktural ditentukan menggunakan spektroskopi gelombang mikro
Molekul metana - Formula struktural ditentukan menggunakan spektroskopi gelombang mikro  Molekul butana - rendering 3 dimensi
Molekul butana - rendering 3 dimensi 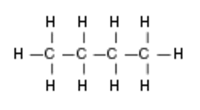 Molekul butana - formula kimia
Molekul butana - formula kimia Reaksi kimia metana dan butana
Butana bereaksi dengan oksigen untuk membentuk karbon dioksida dan uap air. Dalam kondisi oksigen terbatas, butana dapat membentuk karbon monoksida atau karbon hangus. Itu bereaksi dengan klorin untuk memberikan klorobutan dan turunan lainnya. Metana mengalami pembakaran untuk memberikan formaldehyde, karbon monoksida dan akhirnya karbon dioksida dan uap air. Proses ini dikenal sebagai pirolisis.
Kemudahan dalam penanganan
Baik metana dan butana adalah gas tanpa bau pada suhu kamar. Butana dapat dengan mudah dicairkan sehingga dijual sebagai bahan bakar untuk berkemah dan memasak. Dicampur dengan propana dan hidrokarbon lainnya dari LPG yang digunakan secara komersial untuk keperluan pemanasan dan memasak. Metana sulit diangkut dan diangkut dengan pipa dan pembawa LNG.
Tidak seperti metana yang merupakan gas keras kepala dalam tekanan dan suhu normal, butana berubah menjadi cairan saat dikompresi. Properti ini disebabkan oleh ikatan atom karbon sentral yang lemah. Begitu gas cair ini bersentuhan dengan udara, ia bereaksi dengan sumber pengapian dan menjadi mudah terbakar.
Isomer
Butana menunjukkan isomerisme struktural tidak seperti metana dan memiliki dua isomer, n-butana dan iso-butane. Metana tidak menunjukkan isomerisme.
Penggunaan metana vs butana
Butana digunakan dalam deodoran, korek api rokok, silinder gas memasak dan pemanas, propelan dalam semprotan aerosol dan refrigeran dll. Metana juga dikenal sebagai gas rawa atau rawa digunakan untuk menembakkan stasiun pembangkit listrik, mobil daya dll.
Sumber
Metana ditemukan di lahan basah dan lautan, atmosfer, sumber manusia seperti bahan bakar yang terbakar, memelihara ternak, fermentasi bahan organik dll. Butana dapat diperoleh sebagai produk sampingan selama ekstraksi minyak mentah dan merupakan komponen gas alam.

