Alotrop vs. Isomer

- 2898
- 72
- Herbert Konopelski
Alotrop adalah modifikasi struktural yang berbeda dari suatu unsur sedangkan isomer adalah senyawa kimia yang memiliki formula molekul yang sama tetapi memiliki formula struktural yang berbeda.
Elemen tertentu dapat ada dalam dua atau lebih bentuk yang berbeda. Bentuk -bentuk ini disebut alotrop di mana atom elemen terikat bersama dengan cara yang berbeda. Misalnya, dioksigen (o2), ozon (o3), tetraoksigen (o4) dan octaoxygen (o8) adalah alotrop oksigen. Contoh lain adalah karbon yang alotropnya termasuk grafit dan berlian. Singkatnya, alotrop mengandung elemen yang sama (atom yang sama) yang terikat bersama dengan cara yang berbeda untuk menghasilkan struktur molekul yang berbeda.
Sebaliknya, isomer adalah senyawa (Lihat Elemen vs. Senyawa) yang memiliki formula molekul yang sama tetapi memiliki formula struktural yang berbeda. Isomer tidak berbagi sifat kimianya kecuali mereka termasuk dalam kelompok fungsional yang sama. Misalnya, propanol memiliki formula C3H8O (atau c3H7OH) dan terjadi sebagai dua isomer: propan-1-ol (N-propyl alkohol; SAYA) dan propan-2-ol (isopropil alkohol; Ii). Perbedaan antara kedua isomer terletak pada posisi atom oksigen: ia melekat pada karbon ujung pada propan-1-ol, dan ke tengah karbon dalam propan-2-ol. Ada isomer ketiga C3H8O Yang propertinya sangat berbeda sehingga bukan alkohol (seperti propanol) tetapi eter. Disebut methoxyethane (metil-etil-eter; AKU AKU AKU), isomer ini memiliki oksigen yang terhubung ke dua karbon daripada satu karbon dan satu hidrogen.
Grafik perbandingan
| Alotrop | Isomer | |
|---|---|---|
| Definisi | Alotrop adalah modifikasi struktural yang berbeda dari suatu elemen. Misalnya O dan O2 | Isomer adalah senyawa kimia yang memiliki formula molekul yang sama tetapi memiliki formula struktural yang berbeda. |
| Contoh | Berlian, grafit dll. | 2-methylpropan-1-ol dan 2-methylpropan-2-ol. |
Sejarah alotrop dan isomer
Baik alotropi dan isomerisme adalah konsep yang diusulkan oleh ilmuwan Swedia Jöns Jakob Berzelius. Dia mengusulkan konsep alotropi pada tahun 1841. Setelah penerimaan hipotesis Avogadro pada tahun 1860 dipahami bahwa unsur -unsur dapat ada sebagai molekul polyatomic, dan dua alotrop oksigen diakui sebagai O2 dan o3. Pada awal abad ke -20 diakui bahwa kasus -kasus lain seperti karbon disebabkan oleh perbedaan struktur kristal.
Isomerisme pertama kali diperhatikan pada tahun 1827, ketika Friedrich Woehler menyiapkan asam sianat dan mencatat bahwa meskipun komposisi unsurnya identik dengan asam fulminic (disiapkan oleh Justus von Liebig tahun sebelumnya), sifat -sifatnya sangat berbeda. Temuan ini menantang pemahaman kimia yang berlaku tentang waktu itu, yang menyatakan bahwa senyawa kimia hanya bisa berbeda ketika mereka memiliki komposisi unsur yang berbeda. Setelah penemuan tambahan dari jenis yang sama dibuat, seperti penemuan Woehler tahun 1828 bahwa urea memiliki komposisi atom yang sama dengan sianat amonium yang berbeda secara kimia, Jöns Jakob Berzelius memperkenalkan istilah tersebut isomerisme untuk menggambarkan fenomena.
Jenis isomer
Kelas isomer yang berbeda termasuk stereoisomer, enansiomer dan isomer geometris.
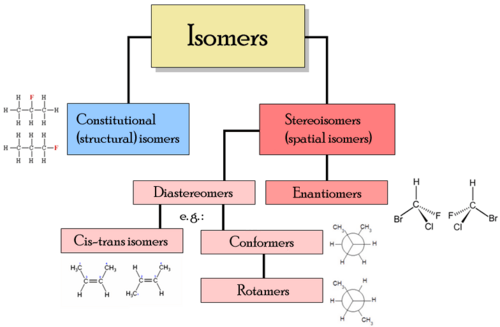 Jenis isomer
Jenis isomer - Isomer struktural - Dalam isomer struktural, atom dan kelompok fungsional bergabung bersama dengan cara yang berbeda. Jenis isomer struktural meliputi:
- Isomerisme rantai - Rantai hidrokarbon memiliki jumlah percabangan yang bervariasi
- Posisi isomerisme - berurusan dengan posisi kelompok fungsional pada rantai
- Isomerisme kelompok fungsional - Salah satu kelompok fungsional dibagi menjadi yang berbeda.
- Isomer kerangka - Rantai karbon utama berbeda antara dua isomer.
- Tautomer - Isomer struktural dari zat kimia yang sama yang secara spontan saling bertentangan satu sama lain.
- Stereoisomer - Dalam stereoisomer, struktur ikatannya sama, tetapi posisi geometris atom dan kelompok fungsional di ruang angkasa berbeda. Jenis stereoisomer meliputi:
- Enantiomer - Isomer yang berbeda adalah cermin cermin yang tidak dapat dituntun satu sama lain
- Diastereomer - isomer bukan gambar mirro satu sama lain

