Perbedaan antara asam kuat dan lemah
- 4662
- 515
- Rodney Hegmann
Asam adalah zat kimia yang menyumbangkan ion hidrogen atau proton saat dicampur dalam larutan. Jumlah proton yang dilepaskan oleh asam tertentu sebenarnya menentukan kekuatan asam - apakah itu asam yang kuat atau asam lemah. Untuk memahami kekuatan asam, orang perlu membandingkan kecenderungan mereka untuk menyumbangkan proton ke basa yang sama (kebanyakan air). Kekuatan dilambangkan dengan nomor yang disebut PKA.

Apa itu asam yang kuat?
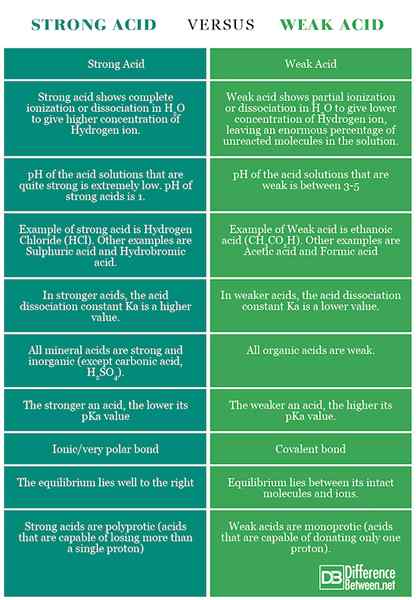
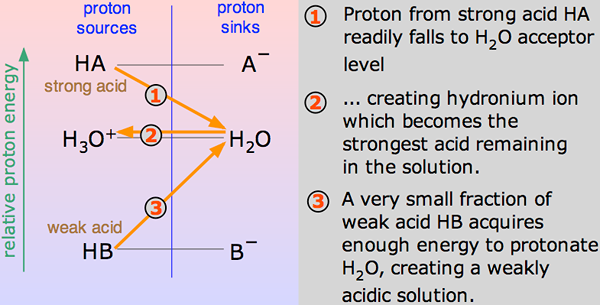
Asam dikatakan kuat jika memisahkan atau mengion sepenuhnya dalam suatu larutan. Itu berarti, itu mampu memberikan jumlah ion atau proton H+ terbesar saat dicampur dalam solusi. Ion -ion ini adalah partikel yang bermuatan. Karena asam kuat menyumbangkan lebih banyak ion saat rusak, atau ionisasi, itu berarti asam yang kuat adalah konduktor listrik.
Saat asam bercampur dalam h2O, proton (h+ ion) dibawa ke h2O Molekul untuk menghasilkan H3O+ (Ion hidroksium) dan ion - berdasarkan asam mana yang terlibat untuk memulai.
Dalam skenario umum,
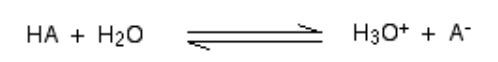
Reaksi kimia seperti itu dapat dihormati, tetapi dalam beberapa kasus, asam diberikan h+ ion cukup mudah dan reaksinya terlihat seperti satu arah. Dan asam sepenuhnya dipisahkan.
Untuk e.G., Saat hidrogen klorida larut dalam H2O Untuk membuat HCl, begitu sedikit reaksi terbalik terjadi sehingga kita dapat menulis:

Pada suatu waktu, reaksi virtual seratus persen akan terjadi di mana hidrogen klorida akan menunjukkan reaksi dengan H3O+ (Ion hidroksium) dan cl- ion. Di sini, asam yang kuat adalah hidrogen klorida.
Apa itu asam lemah?
Asam dikatakan lemah jika terionisasi sebagian atau tidak lengkap, hanya mengeluarkan beberapa atom hidrogennya ke dalam larutan. Oleh karena itu, kurang mampu dibandingkan dengan asam yang kuat dalam memberikan proton. Asam lemah memiliki pKa yang lebih tinggi daripada asam kuat.
Asam Etanoat adalah contoh yang baik dari asam lemah. Itu menunjukkan reaksi dengan h2O Untuk memproduksi H3O+ (Ion hidroksium) dan ch3COOH (ion etano), tetapi reaksi terbalik menunjukkan lebih banyak keberhasilan daripada yang maju. Molekul bereaksi dengan cukup mudah untuk memperbaiki asam dan H2HAI.

Setiap saat, hanya sekitar satu persen dari CH3Molekul asam COOH menunjukkan konversi menjadi ion. Apapun yang tersisa adalah molekul asam asetat sederhana (secara sistematis disebut asam etanoat).
Perbedaan antara asam kuat dan asam lemah
-
Definisi
Asam kuat
Asam kuat adalah asam yang terionisasi sepenuhnya dalam larutan berair. Asam yang kuat akan selalu kehilangan proton (A H+) saat dilarutkan dalam H2HAI. Dengan kata lain, asam kuat selalu ada di kaki dan cukup efisien dalam memberikan proton.
Asam lemah
Asam lemah adalah yang terionisasi sebagian dalam larutan. Itu hanya mengeluarkan sedikit atom hidrogen ke dalam larutan. Oleh karena itu kurang mampu daripada asam yang kuat.
-
Konduktivitas listrik
Asam kuat
Asam kuat akan selalu menunjukkan konduktivitas yang kuat. Asam kuat biasanya melewati lebih banyak arus dibandingkan dengan asam lemah untuk tegangan dan konsentrasi yang sama.
Asam lemah
Asam lemah memiliki konduktivitas rendah. Mereka adalah konduktor yang buruk dan menunjukkan nilai rendah untuk kelulusan saat ini
-
Laju reaksi
Asam kuat
Laju reaksi lebih cepat pada asam yang kuat
Asam lemah
Laju reaksi lebih lambat dalam asam lemah
-
Contoh
Asam kuat
Asam klorida (HCl), asam nitrat (HNO3), Asam perklorat (HCLO4), Asam sulfat (h2JADI4), Asam hidroiodik (HI), asam hidrobromat (HBR), asam klorat (HCLO3).
Asam lemah
Asam belerang (h2JADI3), Asam asetat (ch3COOH), asam fosfat (h3PO4), Asam benzoat (c6H5COOH), asam hidrofluorat (HF), asam format (HCOOH), asam nitrat (HNO2).
-
ph
Asam kuat
Dalam asam yang kuat, pH lebih rendah dari, umumnya 3. Asam kuat memiliki konsentrasi ion H+ yang sangat tinggi (asam yang memiliki pH 3 memiliki 0.001 mol per liter ion hidrogen).
Asam lemah
Asam lemah memiliki pH berkisar antara 3-7.
-
Nilai pKa
Asam kuat
Dalam asam yang kuat, nilai PKA cukup rendah.
Asam lemah
Dalam asam lemah, nilai PKA cukup tinggi.
-
Disosiasi
Asam kuat
HCl (G)+H2O (L) ≈ H3HAI+(aq)+cl-(aq)
Asam lemah
Ch3COOH (L)+H2O (L) ≈ H3HAI+(aq)+ch3MENDEKUT-(aq)
Ringkasan Asam Kuat VS. Asam lemah
Titik perbedaan antara asam kuat dan lemah telah dirangkum di bawah ini: Bagan Perbandingan