Perbedaan antara periode dan kelompok
- 1725
- 441
- Dana Schmitt DDS
Periode dan kelompok adalah dua klasifikasi penting yang digunakan ahli kimia kuno untuk mengatur tabel periodik ikonik menjadi kolom dan baris. Periode adalah baris horizontal sementara kelompok, juga disebut keluarga, adalah kolom vertikal. Elemen diatur ke dalam kelompok dan periode berdasarkan karakteristik tertentu seperti sifat kimia/fisik untuk kelompok dan konfigurasi elektron untuk periode tersebut. Artikel tersebut mengungkap perbedaan lebih lanjut antara periode dan kelompok.

Apa periode?
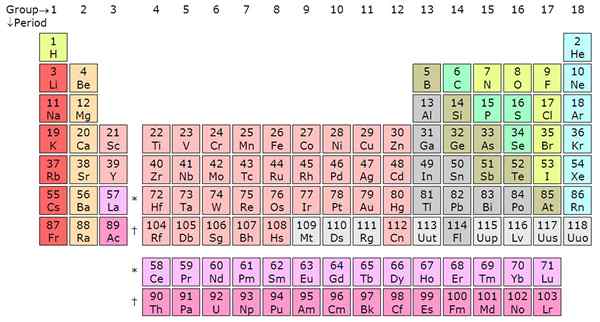
Menghitung dari kiri ke paling kanan di atas meja periodik, itu adalah periode. Biasanya ada 7 periode dalam tabel periodik dan setiap periode menunjukkan cangkang energi baru. Dari hidrogen ke francium pada periode 7, elemen meningkat dalam orbital atom. Ini berarti elektron elemen akan diwakili pada jumlah tingkat energi tertentu sesuai dengan label periodik.
Lithium (Li), misalnya, memiliki dua cangkang energi karena pada periode 2 sedangkan kalium (k) memiliki empat kerang energi karena dalam periode 4. Tren ini berlaku untuk semua elemen lainnya. Dalam suatu periode, elemen -elemen berbagi elektron kulit luar (valensi). Misalnya, hidrogen dan helium berada dalam kelompok yang sama dan memiliki satu elektron di cangkang luar. Perhatikan bahwa periode pertama hanya memiliki dua elemen. Yang kedua dan periode ketiga masing -masing memiliki 8 elemen.
Periode 4 dan 5 masing -masing memiliki 18 elemen. Tabel periodik, secara total, 18 kelompok sesuai sistem penamaan IUPAC. Periode 6 dan 7 adalah pengecualian karena mengandung 32 elemen secara total. Ini menjelaskan mengapa tabel periodik dipersingkat dengan menghapus bagian dari periode 6 dan 7 dan ditampilkan tepat di bawah tabel periodik. Periodik akan besar jika aktinida dan lanthanides tidak dihilangkan. Unsur-unsur yang terpisah ini adalah logam transisi dalam dan mereka mengisi blok-F di orbital atom. Lanthanides termasuk elemen dari 58 hingga 71 sedangkan actinides termasuk elemen dari 89 hingga 103.
Karakteristik lain bahwa elemen -elemen dalam suatu periode saham adalah peningkatan energi ionisasi. Atom dalam periode peningkatan jumlah atom karena lebih banyak proton semakin ditambahkan. Ini meningkatkan daya tarik dalam nukleus dan akan menjadi relatif sulit untuk menghilangkan elektron. Kenaikan muatan nuklir di seluruh tabel periodik. Juga, elektronegativitas meningkat saat Anda bergerak dari kiri ke kanan melintasi periode tersebut. Afinitas elektron juga meningkat karena lebih banyak elektron ditambahkan sehingga meningkatkan gaya tarik yang kuat dengan nukleus.
Apa itu kelompok?
Saat Anda menghitung mundur dari atas ke bawah sepanjang kolom, Anda menghitung grup. Gaya penamaan Eropa ꟷ sekarang diadopsi sebagai gaya penamaan IUPAC, digunakan untuk memberi nama kelompok dari 1 hingga 18. Gaya AS menggunakan AS dan BS.
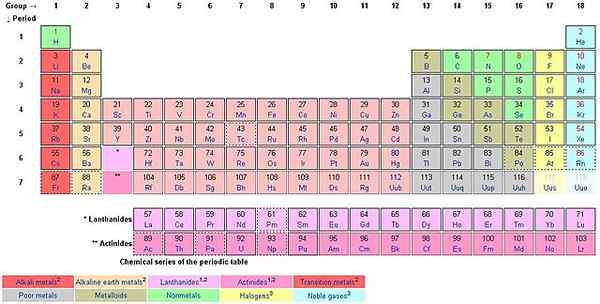
Masing -masing dari 18 kelompok menyandang nama. Misalnya, kelompok pertama dikenal sebagai keluarga lithium (logam alkali), kelompok 2 keluarga berilium (Alkali Bumi Logam, Kelompok 3 Keluarga Skandium, Kelompok 4 Keluarga Titanium, Kelompok 5 Keluarga Vanadium, Kelompok 6 Keluarga Kromium , Kelompok 7 Keluarga Mangan, Kelompok 8 Keluarga Besi, Kelompok 9 Keluarga Kobalt, Kelompok 10 Keluarga Nikel, Kelompok 11 Keluarga Tembaga (Logam Koin), Kelompok 12 Keluarga Seng (Logam Volatile), Kelompok 13 Keluarga Boron (Icoasagens), Kelompok karbon Grup 14 (kristalogen, tetrels), kelompok 15 Keluarga nitrogen (pentel), kelompok 16 Keluarga oksigen (chalcogens), kelompok 17 keluarga fluor (halogen), dan kelompok 18 helium atau keluarga neon ( gas mulia).
Elemen -elemen dalam kelompok berbagi sifat kimia atau fisik. Kelompok 18, misalnya, disebut sebagai gas mulia. Mereka tidak reaktif dengan elemen lain. Aturan oktet 8 elektron di cangkang luar berlaku sempurna untuk gas mulia. Semua elemen lain berusaha untuk mencapai aturan oktet. Hidrogen tidak mengikuti aturan oktet dan begitu juga helium meskipun stabil dan bagian dari gas mulia.
Tabel periode memiliki campuran logam, non-logam dan metaloid (semimetal). Ada elemen pengelompokan tertentu sesuai dengan sifatnya yang serupa dan ini termasuk logam alkali, logam tanah alkali, logam transisi (lantanida, logam tanah jarang dan aktinida), bukan logam, logam, gas mulia, halogen dan logam dasar.
Ada juga tren peningkatan properti saat Anda turun atau menaikkan grup. Saat Anda naik, afinitas elektron 9electron loving) meningkat. Saat Anda turun kelompok, kerang energi meningkat dan dengan demikian daya tarik dalam nukleus berkurang maka afinitas elektron berkurang saat Anda turun. Elektronegatif juga berkurang saat Anda turun kelompok karena peningkatan tingkat energi di bawah kelompok. Elektron dalam cangkang luar cenderung jauh dari nukleus sehingga kumpulan berkurang.
Perbedaan utama antara periode dan kelompok
Lokasi di Tabel Periodik
Periode adalah baris horizontal sedangkan kelompok adalah kolom vertikal pada tabel periodik. Ada 7 periode dan 18 kelompok. Periode 6 dan 7 memiliki 32 elemen karena penambahan actinides dan lanthanides.
Mendefinisikan karakteristik
Elemen dalam kelompok berbagi sifat kimia atau fisik yang serupa. Mereka memiliki jumlah elektron valensi yang sama. Di sisi lain, elemen pada periode yang sama berbagi konfigurasi elektron yang sama.
Elektronegativitas
Elektronegatif berkurang saat Anda turun kelompok dan meningkat saat Anda naik karena peningkatan tarikan nukleus sebagai akibat dari tingkat energi yang lebih sedikit. Elektronegativitas meningkat saat Anda beralih dari kiri ke kanan melintasi periode dengan penambahan lebih banyak proton seiring dengan meningkatnya jumlah atom.
Periode vs. Grup: Bentuk Tabel

Ringkasan periode vs. Kelompok
- Tabel periodik diatur menjadi periode dan kelompok
- Grup adalah kolom vertikal sementara periode adalah baris horizontal
- Elemen dalam kelompok berbagi sifat kimia atau fisik sedangkan elemen dalam suatu periode memiliki konfigurasi elektron yang sama
- Ada 7 periode dan 18 kelompok di atas tabel periodik
- Elektronegativitas meningkat dari kiri ke kanan dalam periode dan dari bawah ke atas dalam kelompok

