Perbedaan antara molekul dan senyawa
- 1799
- 319
- Rodney Hegmann
 Molekul vs senyawa
Molekul vs senyawa
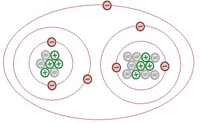
Molekul muncul ketika dua atau lebih atom berinteraksi secara kimia dan bergabung bersama. Senyawa juga merupakan molekul tetapi mengandung atom minimum dua atau lebih elemen. Umumnya semua senyawa dapat dianggap sebagai molekul tetapi molekul bukan senyawa.
Molekul dapat paling tepat didefinisikan sebagai kelompok atom yang diikat dalam pengaturan yang pasti. Senyawa adalah masalah yang terdiri dari lebih dari satu jenis atom '”dengan kata lain, lebih dari satu jenis elemen. Semua senyawa tidak terdiri dari molekul terpisah, namun. Sebagai contoh, natrium klorida (NaCl) adalah garam meja dan senyawa ionik terdiri dari rantai sodium Na+ dan Cl- yang terus berulang yang tidak, dalam logika kata yang paling ketat, molekul.
Cukup kita bisa mendefinisikan sebagai '¦
Senyawa adalah zat yang terdiri dari dua elemen atau lebih yang memiliki ikatan kimia antara satu sama lain dalam persentase permanen berdasarkan massa. Molekul adalah bagian terkecil dari suatu senyawa. Satu atau lebih atom yang secara kimia bersatu untuk membentuk molekul. Hidrogen molekul (H2), oksigen molekul (O2) dan nitrogen molekul (N2) bukan senyawa karena masing -masing terdiri dari jenis elemen tunggal. Molekul tidak memiliki muatan listrik di atasnya, dan dapat ada dalam bentuk padat, cair, atau gas dengan bobot dan ukuran yang berbeda. Molekul adalah komponen khusus terkecil di mana materi murni dapat dibagi dan menjaga komposisi dan sifat kimianya. Pemisahan menjadi bagian yang lebih kecil i.E atom, melibatkan menyelesaikan ikatan kimia yang menyatukan molekul bersama. Semua zat memiliki urutan diatomik atau polyatomic dalam molekul yang tidak seperti gas Nobel jika atom tunggal adalah molekul. Atom -atomnya sama dalam molekul seperti molekul oksigen (O2) mengandung dua atom oksigen yang terikat secara kimia bersama sementara dalam senyawa molekul yang berbeda bersatu untuk membuat senyawa seperti pada atom glukosa (C6H12O6) yang selalu unite menjadi molekul di dalam molekul di dalam molekul di dalam molekul di dalam molekul dalam glukosa (C6H12O6) yang selalu unite ke dalam molekul dalam molekul dalam dalam molekul dalam dalam molekul dalam dalam molekul dalam dalam molekul dalam molekul di dalam molekul dalam molekul di dalam molekul di dalam Besarnya tetap. Ikatan kovalen antara molekul memberi mereka bentuk dan sifat tertentu.
Contoh umum molekul dan senyawa:
Metana (CH4), karbon dioksida (CO2) dan air (H2O) adalah salah satu senyawa yang umum diketahui yang terdiri dari unsur -unsur. Air adalah senyawa yang terdiri dari molekul hidrogen dan oksigen karena itu pada senyawa yang disebutkan di atas partikel terkecil didefinisikan sebagai molekul dan subdivisi lebih lanjut menyebabkan pemecahan ikatan antara molekul dan dengan cara ini atom terbentuk. Molekul gas adalah oksigen, helium, dan nitrogen; Sedangkan contoh molekul padat adalah perak (SI), dan uranium (U). Merkuri (HG) hanyalah molekul perak logam cair.
Senyawa dapat dikenali dengan formula kimianya yang mengidentifikasi molekul yang digabungkan untuk membuat senyawa. Senyawa yang paling terkenal adalah H2O, yaitu kombinasi dua molekul hidrogen dan satu molekul oksigen; umumnya dikenal sebagai air. Garam meja senyawa rumah tangga lainnya yang paling umum diidentifikasi oleh formula NaCl, yaitu kombinasi satu molekul natrium dan satu molekul klorin. Ketika senyawa dibuat dari molekul yang berbeda, reaksi kimia terjadi untuk menciptakan perubahan molekul, dan elemen -elemen tersebut distabilkan menjadi bentuk baru dengan sifat, warna dan bentuk yang berbeda. Molekul yang hanya memiliki satu jenis atom, seperti O2, yang merupakan oksigen, tidak dianggap sebagai senyawa; Karena untuk menjadi senyawa, ia harus harus digabungkan dengan jenis atom yang berbeda untuk membentuk senyawa.
Molekul dapat dikenali dengan bobot, ukuran, dan pengaturannya. Kami dapat memisahkan molekul selama reaksi kimia, dan menggabungkannya untuk membuat molekul yang lebih besar, atau seseorang dapat menggabungkan beberapa molekul dengan berbagai jenis molekul untuk membentuk senyawa.
Ringkasan:
1. Komposisi molekul terjadi dengan kombinasi satu atau lebih atom dan molekul dapat ada dalam keadaan padat, cair atau gas. Di sisi lain senyawa terbuat dari kombinasi molekul yang berbeda sehingga molekul dianggap sebagai komponen penting dari suatu senyawa.
2. Molekul dikenali oleh berat dan ukurannya, dan dapat bersatu untuk membentuk molekul yang lebih besar, atau dipisahkan oleh reaksi kimianya.
3. Molekul dalam senyawa secara kimia terikat bersama.
4. Senyawa diidentifikasi oleh formula seperti H2SO4, NaCl dan H2O
5. Beberapa contoh terkenal molekul adalah hidrogen, oksigen, emas, atau amonia.
6. Beberapa contoh umum senyawa adalah asam karbon hidroklorat, natrium bikarbonat dan glukosa.
7. Senyawa menunjukkan sifat kimia dan fisik yang berbeda dibandingkan dengan molekul komponennya.
Referensi:
Konten tertulis di atas adalah dalam bentuk asli dan unik dan membantu menulis artikel diambil dari sumber -sumber berikut (hanya untuk tujuan informasi) dan artikel telah ditulis dalam format yang sepenuhnya baru dan unik dan akan hanya memiliki kepemilikan majikan:-
A.Kimia Organik / Anorganik (Buku Kursus Tingkat Kelulusan di Universitas Punjab Lahore Pakistan).

