Perbedaan antara massa molar dan massa molekul
- 1108
- 96
- Mr. Doug Effertz
Ahli kimia sering mengukur zat dengan menggunakan massa molar dan massa molekul. Contohnya adalah menentukan jumlah molekul dalam silinder. Kimia mempelajari interaksi atom dan molekul pada skala atom.

Apa itu massa molekul?
Pertama, molekul mengacu pada komposisi atom yang serupa atau berbeda yang diatur dalam rasio. Molekul dapat membentuk senyawa kimia yang tunduk pada sifat fisik dan kimia dari masing -masing molekul.
Singkatnya, massa molekul mengacu pada massa total suatu zat. Itu merangkum massa rata -rata atom individu dalam molekul zat tertentu.
Untuk menentukan massa molekul senyawa X, Anda harus menambahkan massa atom dari semua elemen dalam komposisi termasuk multiplikasinya sesuai dengan subskrip dalam rumus.
Kami akan mengilustrasikan dengan contoh di bawah ini. Massa atom ini diambil langsung dari tabel elemen periodik. Mereka diukur dalam unit massa atom (AMU) dan begitu juga massa molekul.
Contoh 1:
Tentukan massa molekul H2O dan CH3CH2OH.
Menjawab:
Anda harus menilai komposisi formula molekul yang diberikan dan memperoleh massa atomnya dari tabel periodik. Memperhitungkan subskrip.
Misalnya, H2O menunjukkan bahwa ada dua atom hidrogen dan satu atom oksigen. Massa atom hidrogen, dari tabel periodik, 1.0079 Amu dan oksigen adalah 15.9994. Massa molekul senyawa adalah 2 (1.0079) + 15.9994 = 18.0152 AMU.
Dan untuk menentukan massa molekul etanol, formula lain yang diberikan dalam pertanyaan, kami mengikuti langkah yang sama. Ada 2 atom karbon, 6 atom hidrogen dan 1 atom oksigen. Massa atom atom karbon adalah 12.011 AMU. Yang mengatakan, massa molekul CH3CH2OH adalah 2 (12.011) + 6 (1.0079) + 1 (15.9994) = 46.069 Amu. Untuk latihan Anda, hitung formula molekul etana (C2H4) dan CO2.
Apa itu massa molar?
Sekarang mengenai konsep massa molar, ini didefinisikan sebagai massa dalam kilogram atau gram mol zat. Biasanya, unit untuk massa molar adalah gram/mol. Tokongan elemen oksigen memiliki massa 15.9994 gram. Dengan demikian massa molar akan menjadi 15.9994 g/mol. Untuk senyawa karbon dioksida, misalnya, massa molar didefinisikan sebagai massa 1 mol molekul dalam senyawa tersebut. Nomor Avogadro, 6.022 x 1023 sering digunakan untuk menghubungkan jumlah atom, molekul dan unit lain yang disamakan oleh massa molar. Misalnya, massa molar H2O akan sama dengan massa dalam gram per mol 6.022 x 1023 Molekul Air. Jika ini kedengarannya terlalu teknis, kami akan mengilustrasikan dengan contoh di bawah ini:
Contoh 2:
Tentukan massa molar etanol.
Menjawab:
Dalam contoh pertama, kami menentukan massa molekul etanol (C2H5OH). Jangan bingung dengan formula yang berbeda seperti yang disebutkan di atas. Kami baru saja bermain -main dengan pengaturan struktural formula etanol meskipun rasio atom tetap sama.
Etanol mengandung 6.022 x 1023molekul, dan massa molar sama dengan massa etanol yang mengandung molekul -molekul ini. Kami menemukan massa molekul etanol menjadi 46.069 unit massa atom dalam contoh kami sebelumnya. Prosedur yang sama diikuti dalam menghitung massa molar.
Satu mol etanol memiliki 2 atom karbon mol, 6 mol atom hidrogen dan satu mol atom oksigen. Mengambil massa atom dari tabel periode, kami menemukan bahwa massa molar adalah 2 (12.011g) + 6 (1.0079g) + 15.9994G yang sama dengan 46.069 g/mo. Perhatikan nilai yang sama tetapi unit yang berbeda.
NB: Massa molar zat kimia apa pun mengacu pada massa atomnya atau massa molekul dalam gram per mol. Nilainya sama tetapi unit yang berbeda.
Latihan 2:
Hitung massa molar kalsium fosfat (CA3 (PO4) 2). Jawabannya harus 310.177 g/mol.
Berkenaan dengan karbon, massa molar dari karbon yang terjadi secara alami dengan berbeda dari yang berasal dari tabel periode yang termasuk dalam isotop karbon-12. Secara alami, karbon mengandung karbon-12, karbon-13 dan karbon-14. Tapi mol karbon masih mengandung 6.022 x 1023 tetapi dengan rasio yang berbeda dari isotop ini.
Perbedaan antara massa molar dan massa molekul
Perhitungan massa molar dan massa molekul
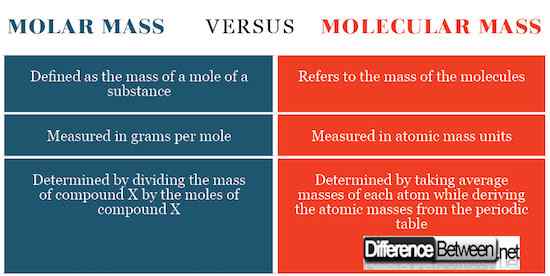
Massa molar ditentukan dengan membagi massa total zat yang merupakan massa rata -rata masing -masing atom dengan jumlah dalam mol. Angka yang dihasilkan adalah gram per mol atau kilogram per mol. Massa molekul ditentukan dengan menghitung massa zat yang terkait dengan 1/12 isotop karbon-12.
Definisi massa molar dan massa molekul
Massa molekul mengacu pada massa molekul sedangkan massa molar mengacu pada massa mol zat.
Unit SI untuk massa molar dan massa molekul
Massa molar dinyatakan sebagai gram per mol sedangkan massa molekul dinyatakan sebagai unit massa atom. Ekspresi unit SI ini kembali ke bagaimana konsep -konsep ini didefinisikan sebagai yang disebutkan di atas.
Ringkasan massa molar vs. Massa molekul
- Massa molar dan massa molekul adalah konsep penting dalam kimia
- Massa molar diekspresikan dalam gram per mol atau kilogram per mol sedangkan massa molekul diekspresikan dalam unit massa atom. Massa molar pada dasarnya tanpa unit.
- Kami menghitung massa molar dengan membagi massa zat dengan jumlah dan menghitung massa molekul dengan mengambil massa rata -rata unit zat tersebut
- Mereka memiliki nilai yang sama tetapi unit SI yang berbeda.

