Perbedaan antara ikatan hidrogen dan ikatan kovalen
- 2127
- 228
- Grant Zieme

Topik ini membuatnya sangat jelas bahwa artikel ini didasarkan pada beberapa konsep dari kimia. Bagi Anda yang mengetahui konsep dasar ikatan kimia, mudah untuk memahami bahwa diskusi adalah tentang dua jenis ikatan. Sedangkan untuk orang lain, mari kita katakan bahwa di antara banyak ikatan kimia yang terjadi antara atom dan molekul, kita akan membahas dan membedakan dua jenis ikatan yang sangat penting, yaitu ikatan hidrogen dan ikatan kovalen.
Sangat sering bagi orang untuk membingungkan keduanya. Ini karena definisi samar yang ditawarkan untuk menjelaskan relatif ini terhadap jenis ikatan lainnya. Definisi paling sederhana yang ditawarkan adalah bahwa ikatan antara dua non-logam biasanya kovalen sedangkan ikatan antara logam dan non-logam adalah ionik. Definisi ini cukup umum dan ada banyak pengecualian serta kontradiksi untuk itu. Pertama-tama, harus dicatat bahwa semua ikatan antara dua non-logam tidak termasuk dalam kategori ikatan kovalen; Ada juga ikatan lain, salah satunya adalah ikatan hidrogen.
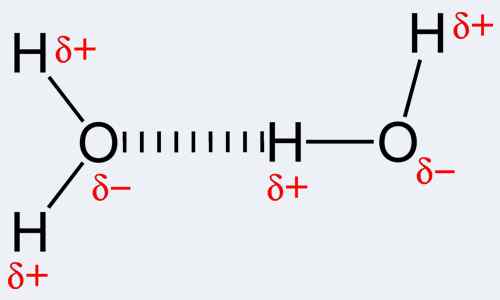
Menurut definisi, ikatan kovalen adalah bentuk ikatan kimia yang terjadi karena berbagi pasangan elektron antara atom yang sama atau berbeda. Ikatan kovalen, pada gilirannya, mengacu pada keseimbangan gaya yang stabil (baik menarik dan menjijikkan) antara atom ketika mereka berbagi elektron. Berbagi memungkinkan setiap atom yang terlibat untuk mencapai cangkang luar yang setara dengan cangkang valensi penuh atau cangkang luar. Ini memperhitungkan konfigurasi elektron yang stabil. Berbeda dengan ini, ikatan hidrogen sebenarnya adalah nama daya tarik elektrostatik antara jenis molekul khusus, yang dikenal sebagai molekul kutub. Ikatan secara unik terjadi ketika atom hidrogen yang sudah terikat pada atom yang sangat elektronegatif (salah satu dari tiga; oksigen, nitrogen atau fluor) mengalami gaya tarik lain dari atom terdekat yang juga sangat elektronegatif. Perhatikan bahwa hidrogen harus ada di sana agar ikatan hidrogen terjadi, dan karenanya nama ikatan. Juga, salah satu dari tiga atom yang disebutkan di atas harus terikat padanya. Ini karena nitrogen, fluor dan oksigen sangat elektronegatif, yaitu menarik elektron ke arah diri mereka sendiri. Ini membuat hidrogen berperilaku sebagai partikel bermuatan positif karena elektron bermuatan negatif telah tertarik pada nitrogen, fluor atau atom oksigen yang sesuai. Oleh karena itu, partikel hidrogen ini, yang sekarang positif, mudah tertarik pada atom elektronegatif lain karena negativitasnya. Untuk menggunakan nama ikatan hidrogen untuk interaksi kimia ini lebih seperti menggunakan kesalahan nomer karena tidak ada ikatan sejati yang terbentuk. Akibatnya, ada tempat-tempat yang berbeda dengan atraksi di-pola.
Interaksi yang terjadi dalam ikatan kovalen termasuk ikatan logam hingga logam, tiga ikatan elektron dua tengah, interaksi agostik, ikatan π dan ikatan σ. Memang dicatat bahwa kovalensi adalah yang terbesar antara atom yang memiliki elektronegativitas yang sama. Ini menyiratkan bahwa kedua atom tidak harus memiliki elemen yang sama tetapi harus memiliki elektronegativitas yang sebanding dan dekat untuk memungkinkan ikatan yang lebih kuat. Berbeda dengan ini, ikatan hidrogen bersifat antarmolekul, yaitu, terjadi antara molekul atau antara berbagai bagian dari satu molekul. Ikatan hidrogen cukup kuat; lebih kuat dari kekuatan van der Waals tetapi lebih lemah dari ikatan kovalen dan ionik. Contoh molekul di mana ikatan hidrogen terjadi termasuk air serta beberapa molekul organik seperti protein, DNA dll.
Ringkasan perbedaan yang diungkapkan dalam poin
1. Ikatan kovalen-A ikatan kimia yang terjadi karena berbagi pasangan elektron antara atom yang sama atau berbeda, ikatan kovalen mengacu pada keseimbangan gaya yang stabil (baik menarik dan menjijikkan) antara atom ketika mereka berbagi elektron, berbagi memungkinkan setiap atom yang terlibat untuk mencapai cangkang luar yang setara dengan cangkang valensi penuh atau cangkang luar; Ikatan hidrogen adalah daya tarik elektrostatik antara jenis molekul khusus, yang dikenal sebagai molekul kutub. Ikatan secara unik terjadi ketika atom hidrogen yang sudah terikat pada atom yang sangat elektronegatif (salah satu dari tiga; oksigen, nitrogen atau fluor) mengalami gaya tarik lain dari atom terdekat yang juga sangat elektronegatif
2. Ikatan kovalen dapat terjadi antara berbagai macam atom; Ikatan hidrogen membutuhkan hidrogen dan salah satu oksigen, nitrogen atau fluorin
3. Ikatan kovalen lebih kuat dari ikatan hidrogen

