Perbedaan antara sel galvanik dan sel elektrolitik
- 4059
- 341
- Mr. Miguel Schultz
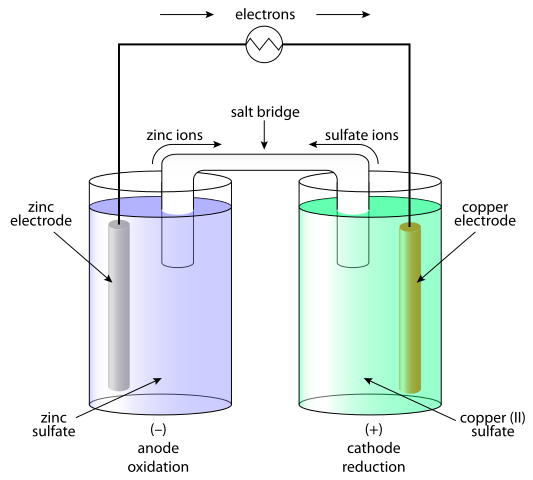
Ada dua jenis sel elektrokimia: sel galvanik - dengan proses redoks spontan yang memungkinkan aliran elektron kontinu melalui konduktor, di mana energi kimia diubah menjadi yang listrik; dan elektrolitik, di mana reaksi redoks dipengaruhi oleh sumber arus eksternal, di mana listrik dikonversi dalam energi kimia.

Apa itu sel galvanik?
Sel galvanik adalah sistem di mana energi kimia diubah menjadi listrik dan sebagai hasilnya arus dihasilkan. Dalam sel galvanik, arus searah dihasilkan sebagai hasil dari proses redoks (oksidasi-reduksi). Elemen galvanik terdiri dari dua setengah sel. Setengah sel terdiri dari elektrolit dan elektroda yang direndam di dalamnya. Di antara setengah sel ini, kontak harus disediakan, menghubungkan elektrolit dengan jembatan garam atau membran semi-konduktif dan menghubungkan elektroda dengan konduktor. Pemisahan proses redoks dijelaskan oleh perilaku elektroda sehubungan dengan elektrolit. Pilihan paling sederhana adalah bahwa setengah sel terbentuk dari elektroda logam yang direndam dalam koresponden ion yang mengandung elektrolit dengan elektroda. Perilaku logam dalam elektrolit tergantung pada reaktivitas logam i.e. kecenderungannya untuk larut.
Apa itu sel elektrolitik?
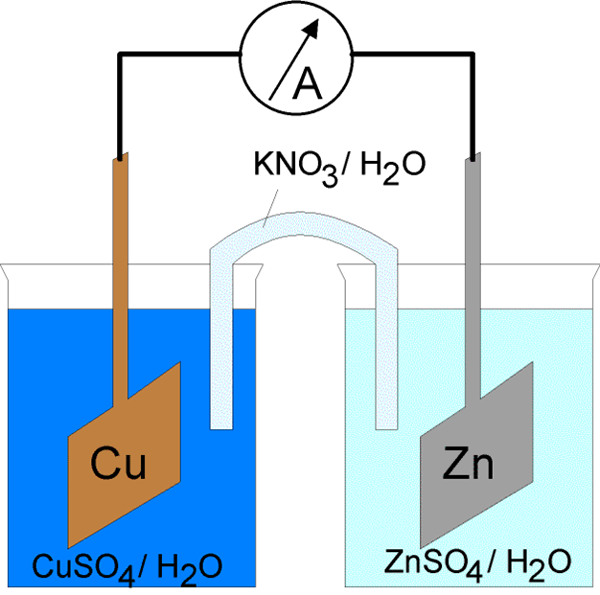
Arus listrik melalui sel elektrokimia dapat dimulai dengan dua cara. Yang pertama adalah menghubungkan elektroda dengan konduktor ke sirkuit listrik tertutup. Dengan menutup sirkuit listrik dimungkinkan untuk secara spontan menginduksi reaksi elektroda pada kedua fase logam/elektrolit. Selain itu, energi arus dilepaskan dengan mengorbankan energi reaksi kimia spontan. Sel yang bekerja dengan cara ini disebut sel galvanik. Ini dijelaskan di atas. Cara lain adalah dengan menutup sirkuit listrik dengan ikatan serial dari sumber arus eksternal yang bertentangan dengan tegangan sel, di mana tegangan eksternal lebih besar dari gaya elektromotif sel sel. Itu menggerakkan arus dalam arah yang berlawanan dari arah aliran spontannya melalui sel. Karena itu, reaksi elektroda dalam sel harus bertentangan dengan arah aliran spontannya. Proses paksa dalam sel elektrokimia di bawah pengaruh sumber eksternal arus listrik disebut elektrolisis, dan sel elektrokimia dalam mode operasi tersebut disebut sel elektrolitik.
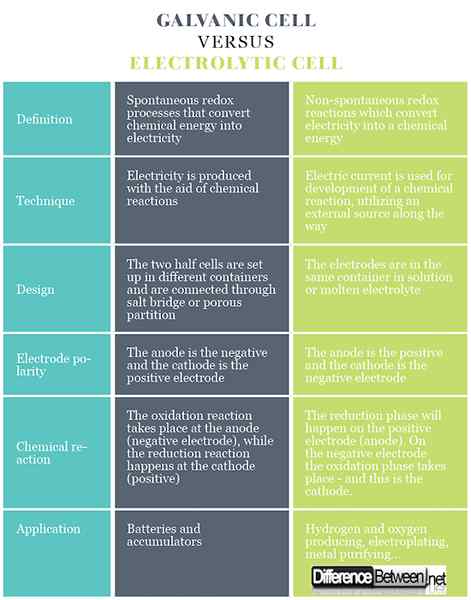
Perbedaan antara sel galvanik dan elektrolitik
-
Definisi sel galvanik dan elektrolitik
Dalam sel galvanik ada proses redoks spontan yang memungkinkan aliran elektron terus menerus melalui konduktor, di mana energi kimia dikonversi menjadi listrik. Dalam sel elektrolitik, reaksi redoks terjadi di bawah pengaruh sumber eksternal, di mana listrik diubah menjadi energi kimia. Reaksi redoks tidak spontan.
-
Teknik sel galvanik dan elektrolitik
Sel galvanik menghasilkan listrik dengan bantuan reaksi kimia. Dalam sel elektrolitik, arus listrik digunakan untuk pengembangan reaksi kimia, menggunakan sumber eksternal di sepanjang jalan.
-
Desain sel galvanik dan elektrolitik
Sel galvanik terdiri dari dua elektroda berbeda yang direndam dalam larutan ion mereka yang dipisahkan oleh membran semipermeabel atau jembatan garam. Sel elektrolitik terdiri dari wadah elektrolitik di mana dua elektroda terhubung ke sumber DC. Elektrolit mungkin meleleh atau larutan berair dari beberapa garam, asam atau alkali.
-
Polaritas elektroda dalam sel galvanik dan elektrolitik
Dalam sel galvanik anoda adalah negatif dan katoda adalah elektroda positif. Dalam sel elektrolitik, kebalikannya terjadi.
-
Reaksi kimia dalam sel galvanik dan elektrolitik
Dalam kasus sel galvanik, reaksi oksidasi terjadi pada anoda (elektroda negatif) di mana ada surplus muatan negatif. Di katoda, reaksi reduksi terjadi, mendorong penumpukan muatan yang positif. Dalam kasus sel elektrolitik, sumber luar digunakan untuk memicu reaksi. Pada elektroda negatif, elektron didorong keluar - sehingga fase reduksi akan terjadi pada elektroda negatif. Pada elektroda positif, fase oksidasi terjadi - dan ini adalah anoda.
-
Penerapan sel galvanik dan elektrolitik
Sel galvanik digunakan sebagai sumber arus listrik, dan lebih sering disebut sebagai baterai atau akumulator. Sel elektrolitik memiliki kegunaan praktis yang berbeda, beberapa di antaranya membuat gas hidrogen dan oksigen untuk aplikasi komersial dan industri, elektroplating, mengekstraksi logam murni dari paduan dan sebagainya.
Galvanik vs. Sel Elektrolitik: Perbandingan dalam Bentuk Tabel
Ringkasan Galvanik VS. Sel elektrolitik
- Sel elektrokimia terdiri dari dua sel setengah atau elektroda yang kontaknya dibuat melalui elektrolit (konduktor ionik). Setengah sel, jika dipisahkan, dapat digabungkan dengan jembatan garam (larutan elektrolit pekat dalam gel agar-agar)). Sel galvanik menghasilkan arus listrik berdasarkan perubahan kimia yang terjadi secara spontan di dalamnya. Sel elektrolitik melakukan sebaliknya: hasil saat ini dalam perubahan kimia. Agar sel menjadi galvanik, perubahan kimia spontan harus terjadi di dalamnya.

