Perbedaan antara bromin dan klorin

- 3507
- 531
- Richard Hegmann MD
Kelompok sistem periodik termasuk elemen fluor (f), klorin (cl), bromin (BR), yodium (i) dan astatin (AT). Semua elemen ini dikenal dengan nama generik "elemen halogen" dan memiliki sifat kimia non -logam.

Apa itu bromin?
- Bromine (BR) adalah elemen kimia non-logam dari kelompok VIIA dari sistem periodik, yang dalam kondisi normal adalah cairan coklat kemerahan dengan bau yang sangat menjengkelkan.
- Brom adalah nomor 35 dalam tabel periodik dan memiliki massa atom 79.904.
- Itu kurang reaktif dari klorin. Namun, dalam kondisi normal, bromin berpartisipasi dalam beberapa interaksi kimia.
- Larutan encer bromin molekul (2.8%) disebut air brom dan digunakan dalam banyak reaksi organik. Secara umum, bromin sangat larut dalam pelarut organik. Seringkali, dalam senyawa, menunjukkan keadaan oksidasi -1, tetapi juga dapat dalam keadaan oksidasi positif ganjil (+1, +3, +5, +7).
- Di alam, bromin terjadi dalam bentuk campuran dua isotop stabil. Ini terkandung sebagai pengotor dalam klorin mineral halite (NaCl - garam), sylvite (kcl), karnallite (kalium magnesium heksahidrat), dll. Kandungannya di air laut adalah sekitar 1: 660 atom klorin.
- Penggunaan bromin termasuk persiapan farmasi, pestisida, pewarna, tahan api, dll. Di masa lalu, kalium bromida telah digunakan sebagai obat penenang dan antikonvulsan.

Apa itu klorin?
- Klorin (CL) adalah elemen kimia non-logam dari kelompok VIIA dari sistem periodik, yang dalam kondisi normal dalam bentuk gas kuning kehijauan dengan bau yang sangat menjengkelkan.
- Klorin adalah nomor 17 dalam tabel periodik dan memiliki massa atom 35.453.
- Klorin adalah elemen kimia yang sangat aktif. Dalam interaksi kimia, biasanya tampaknya merupakan oksidan yang kuat dan dalam senyawa kimianya paling sering dari keadaan oksidasi -1. Ketika ada oksidan yang lebih kuat dalam molekul, atom klorin memiliki keadaan oksidasi positif. Misalnya, dalam asam perklorat, keadaan oksidasi atom klorin mencapai +7. Klorin dapat hadir di semua keadaan oksidasi dari -1 hingga +7, kecuali +2.
- Di alam, sumber klorin sebagai zat sederhana tidak diketahui sejauh ini dan hanya terjadi dalam bentuk senyawa kimia atau dipisahkan dalam bentuk ion. Mineral yang merupakan sumber klorin adalah halit (NaCl - garam), sylvite (kcl), karnallite (kalium magnesium heksahidrat), dll. Lautan dan lautan mengandung anion klorin karena garam terlarut. Karena kehidupan di bumi berasal dari perairan asin yang sama, cairan internal organisme kita juga mengandung banyaknya ion klorin.
- Klorin adalah bahan baku penting dalam produksi asam klorida. Penggunaannya di rumah tangga cukup signifikan karena merupakan bahan yang paling umum dari produk pembersih bakterisida. Persiapan yang mengandung klorin menghancurkan semua bakteri yang diketahui. Dalam bentuk radikal, atom klorin sangat reaktif, yang menjadikannya karsinogen yang kuat.
Perbedaan antara bromin dan klorin
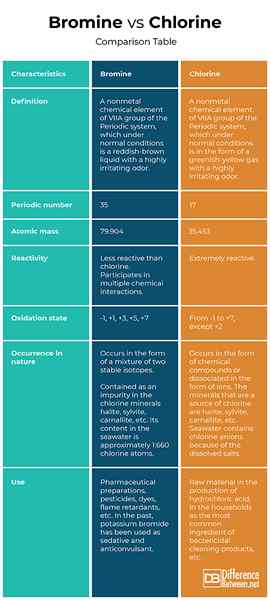
Definisi
Brom: Bromin adalah elemen kimia non-logam dari kelompok VIIA dari sistem periodik, yang dalam kondisi normal adalah cairan coklat kemerahan dengan bau yang sangat menjengkelkan.
Klorin: Klorin adalah elemen kimia non-logam dari kelompok VIIA dari sistem periodik, yang dalam kondisi normal dalam bentuk gas kuning kehijauan dengan bau yang sangat menjengkelkan.
Jumlah Berkala
Brom: Brom adalah nomor 35 di tabel periodik.
Klorin: Klorin adalah nomor 17 di tabel periodik.
Massa atom
Brom: Massa atom brom adalah 79.904.
Klorin: Massa atom klorin adalah 35.453.
Reaktivitas
Brom: Bromin kurang reaktif dari klorin. Namun, dalam kondisi normal, bromin berpartisipasi dalam beberapa interaksi kimia.
Klorin: Klorin adalah elemen kimia yang sangat aktif.
Keadaan oksidasi
Brom: Seringkali dalam senyawa kimia bromin menunjukkan keadaan oksidasi -1, tetapi juga dapat dalam keadaan oksidasi positif aneh (+1, +3, +5, +7).
Klorin: Klorin dapat hadir di semua keadaan oksidasi dari -1 hingga +7, kecuali +2. Ini adalah oksidan yang kuat dan dalam senyawa kimianya paling sering dari keadaan oksidasi -1.
Kejadian di alam
Brom: Di alam, bromin terjadi dalam bentuk campuran dua isotop stabil. Ini terkandung sebagai pengotor dalam klorin mineral halite (NaCl - garam), sylvite (kcl), karnallite (kalium magnesium heksahidrat), dll. Kandungannya di air laut adalah sekitar 1: 660 atom klorin.
Klorin: Di alam klorin hanya terjadi dalam bentuk senyawa kimia atau dipisahkan dalam bentuk ion. Mineral yang merupakan sumber klorin adalah halit (NaCl - garam), sylvite (kcl), karnallite (kalium magnesium heksahidrat), dll. Air laut mengandung anion klor karena garam terlarut.
Menggunakan
Brom: Penggunaan bromin termasuk persiapan farmasi, pestisida, pewarna, tahan api, sanitasi kolam, dll. Di masa lalu, kalium bromida telah digunakan sebagai obat penenang dan antikonvulsan.
Klorin: Klorin digunakan sebagai bahan baku dalam produksi asam klorida, dalam rumah tangga sebagai bahan yang paling umum dari produk pembersih bakterisida, untuk membersihkan kolam, dll.
Bromin vs. Klorin: Tabel Perbandingan
Ringkasan Bromin VS. Klorin
- Bromin adalah elemen kimia non-logam dari kelompok VIIA dari sistem periodik, yang dalam kondisi normal adalah cairan coklat kemerahan dengan bau yang sangat menjengkelkan.
- Klorin adalah elemen kimia non-logam dari kelompok VIIA dari sistem periodik, yang dalam kondisi normal dalam bentuk gas kuning kehijauan dengan bau yang sangat menjengkelkan.
- Brom adalah nomor 35 dalam tabel periodik dan klorin adalah nomor 17.
- Massa atom brom adalah 79.904, massa atom klorin adalah 35.453.
- Bromin kurang reaktif dari klorin. Namun, dalam kondisi normal, bromin berpartisipasi dalam beberapa interaksi kimia.
- Seringkali dalam senyawa kimia bromin menunjukkan keadaan oksidasi -1, tetapi juga dapat dalam keadaan oksidasi positif aneh (+1, +3, +5, +7). Klorin dapat hadir di semua keadaan oksidasi dari -1 hingga +7, kecuali +2.
- Di alam, bromin terjadi dalam bentuk campuran dua isotop stabil. Klorin hanya terjadi dalam bentuk senyawa kimia atau dipisahkan dalam bentuk ion.
- Penggunaan bromin termasuk persiapan farmasi, pestisida, pewarna, tahan api, sanitasi kolam, dll. Di masa lalu, kalium bromida telah digunakan sebagai obat penenang dan antikonvulsan. Klorin digunakan sebagai bahan baku dalam produksi asam klorida, dalam rumah tangga sebagai bahan yang paling umum dari produk pembersih bakterisida, untuk membersihkan kolam, dll.

