Perbedaan antara adiabatik, isotermal dan isobarik
- 1904
- 202
- Mr. Jordan Gusikowski

Apa adiabatik?
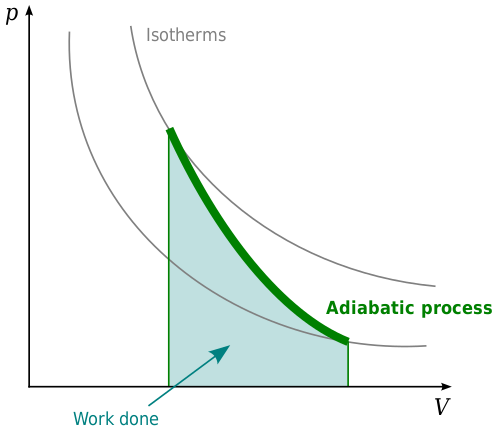
Sistem atau proses adiabatik adalah sistem di mana tidak ada perubahan bersih dalam energi panas. Proses adiabatik terkait dengan hukum termodinamika pertama. Undang -undang ini menyatakan bahwa ketika energi panas ditempatkan ke dalam suatu sistem, ia akan mengubah energi internal sistem atau akan melakukan pekerjaan. Ini terkait dengan hukum konservasi energi yang menyatakan bahwa materi dan energi tidak dapat diciptakan atau dihancurkan. Dalam konteks termodinamika, energi panas dalam suatu sistem harus melakukan sesuatu. Itu akan mengubah energi internal sistem, melakukan pekerjaan, atau kombinasi keduanya. Itu tidak bisa begitu saja menghilang.
Dalam sistem adiabatik, tekanan, volume, dan suhu akan berubah sedemikian rupa sehingga energi panas tetap konstan. Proses adiabatik paling jelas terlihat dalam gas. Pemanasan adiabatik dalam gas akan menyebabkan suhu meningkat seiring dengan meningkatnya tekanan pada gas. Jika tekanan pada gas berkurang, ini akan menyebabkan suhu turun, mengakibatkan pendinginan adiabatik. Dengan pemanasan adiabatik, gas akan dikompresi dan dengan demikian pekerjaan akan dilakukan pada gas oleh lingkungan. Jika pendinginan adiabatik terjadi, ini akan mengakibatkan gas yang meluas dan gas akan bekerja di lingkungan.
Contoh di mana proses adiabatik penting dalam konteks piston, seperti piston di mesin diesel. Ketika tekanan dari piston meningkat, gas akan berkontraksi. Dengan dekompresi, gas akan mengembang lagi, menggerakkan piston. Ini dikendalikan oleh proses adiabatik.
Proses adiabatik penting dalam meteorologi. Jika sebungkus udara naik, tekanan pada parsel udara akan berkurang dan ini akan menyebabkan suhu udara menurun karena pendinginan adiabatik. Di sisi lain, jika airmass didorong ke tanah, itu akan menyebabkan tekanan pada airmass meningkat, menghangatkan airmass. Karena tekanan udara berkurang dengan ketinggian, suhu akan berkurang dengan tinggi di atmosfer. Laju suhu berkurang dengan meningkatnya ketinggian dikenal sebagai laju selang adiabatik.
Apa itu isotermal?
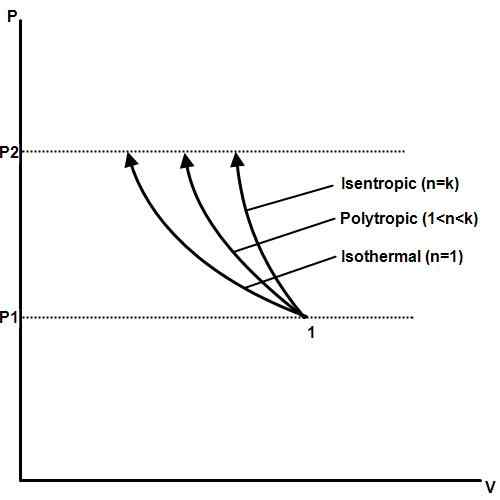
Proses isotermal adalah proses di mana suhunya tetap konstan bahkan jika tekanan dan volume berubah. Dalam termodinamika, tekanan, suhu, dan volume terkait dengan hukum gas Boyle. Jika seseorang tetap konstan, yang lain akan berubah proporsional satu sama lain. Jika suhu gas dipegang konstan, tekanan dan volume gas akan sebanding berbanding.
Contoh proses isotermal adalah perubahan fase. Ketika suatu zat, seperti air, mencapai titik leleh atau titik didihnya, tekanan dan suhu akan tetap konstan seperti fase, volume, dan perubahan energi panas.
Proses isotermal membentuk dasar mesin panas yang digunakan dalam pembangkit listrik tenaga listrik, mobil, pesawat terbang, roket, dan mesin lain yang penting untuk peradaban modern. Proses isotermal juga penting dalam biologi, geologi, ilmu ruang angkasa, ilmu planet, dan banyak bidang lainnya.
Apa itu isobarik?
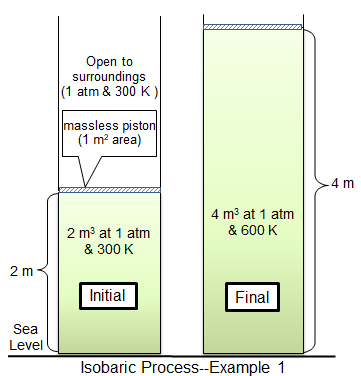
Dalam proses isobarik, tekanan dalam suatu sistem tetap konstan. Dalam kondisi isobarik, volume dan suhu terkait langsung. Jika suhu meningkat, demikian juga volume. Ini dapat diilustrasikan dengan menempatkan balon di dalam freezer. Tekanan baik di dalam balon dan di luar akan tetap konstan, tetapi balon akan mulai menyusut dalam volume saat mendingin.
Contoh lain adalah piston tertimbang yang dipindahkan oleh gas yang dipanaskan dalam silinder. Saat gas dipanaskan, suhu gas naik, dan gas mengembang, mendorong piston. Jika piston diperbaiki dan tidak bisa bergerak, tekanan dalam gas akan naik alih -alih gas yang mengembang dan sistem tidak akan isobarik.
Proses isobarik penting dalam konstruksi mesin panas karena mesin panas tertentu bergantung pada proses isobarik untuk mengubah energi panas menjadi energi mekanik.
Kesamaan antara adiabatik VS. isotermal vs. isobarik
Proses adiabatik, isotermal, dan isobarik semuanya terkait dengan tekanan, suhu, dan volume. Mereka juga semua paling baik diilustrasikan dengan gas. Ketiga jenis proses juga paling relevan di atmosfer planet.
Perbedaan antara adiabatik VS. isotermal vs. isobarik
Meskipun proses ini memiliki kesamaan, mereka juga memiliki perbedaan penting. Ini termasuk yang berikut ini.
- Suhu gas akan berkurang saat gas mengembang dalam sistem adiabatik, sedangkan suhu akan tetap konstan saat gas mengembang dalam sistem isotermal dan meningkat saat gas mengembang dalam sistem isobarik.
- Dalam sistem adiabatik atau isotermal, volume gas berbanding terbalik dengan suhu, sedangkan secara langsung sebanding dengan suhu dalam sistem isobarik.
- Tekanan gas berbanding terbalik dengan volume dalam sistem isotermal, sedangkan tidak berubah dalam sistem isobarik, dan tekanan pada gas berbanding terbalik dengan volume dalam sistem adiabatik.
- Panas tidak berubah dalam sistem adiabatik, sedangkan itu berubah dalam sistem isotermal atau isobarik.
Adiabatik vs. isotermal vs. isobarik

Ringkasan
Dalam sistem adiabatik, tidak ada perubahan bersih dalam panas. Saat gas mengembang, suhu akan turun, yang mengarah ke pendinginan adiabatik. Jika gas terkompresi, suhu akan meningkat, yang mengarah ke pemanasan adiabatik. Proses adiabatik penting dalam sains atmosfer. Dalam proses isotermal, suhu konstan, dan tekanan dan volume saling berbanding. Contoh proses isotermal adalah perubahan fase. Selama perubahan fase, suhu suatu zat tidak akan berubah meskipun panas dan volume berubah. Dalam sistem isobarik, tekanan tetap konstan dan volume akan meningkat atau menurun dengan suhu. Jika volume gas ditempatkan dalam freezer, misalnya, volume gas akan berkurang ukurannya karena tekanannya konstan saat suhunya turun.

