Obligasi Kovalen vs. Obligasi ionik
- 775
- 30
- Ricky Huels
Ada dua jenis ikatan atom - Obligasi ionik Dan ikatan kovalen. Mereka berbeda dalam struktur dan sifatnya. Ikatan kovalen terdiri dari pasangan elektron yang dibagikan oleh dua atom, dan mengikat atom dalam orientasi tetap. Energi yang relatif tinggi diperlukan untuk memecahkannya (50 - 200 kkal/mol). Apakah dua atom dapat membentuk ikatan kovalen tergantung pada elektronegativitasnya i.e. Kekuatan atom dalam molekul untuk menarik elektron ke dirinya sendiri. Jika dua atom sangat berbeda dalam elektronegativitasnya - seperti natrium dan klorida - maka salah satu atom akan kehilangan elektronnya ke atom lainnya. Ini menghasilkan ion bermuatan positif (kation) dan ion bermuatan negatif (anion). Ikatan antara kedua ion ini disebut ikatan ionik.
Grafik perbandingan
| Ikatan kovalen | Obligasi ionik | |
|---|---|---|
| Apa itu? | Ikatan kovalen adalah bentuk ikatan kimia antara dua atom non logam yang ditandai dengan berbagi pasangan elektron antara atom dan ikatan kovalen lainnya. | Ikatan ionik, juga dikenal sebagai ikatan elektrovalen adalah jenis ikatan yang terbentuk dari daya tarik elektrostatik antara ion bermuatan yang berlawanan dalam senyawa kimia. Jenis ikatan ini terjadi terutama antara atom logam dan non logam. |
| Pembentukan | Ikatan kovalen terbentuk antara dua non-logam yang memiliki elektronegativitas serupa. Tidak ada atom yang "kuat" cukup untuk menarik elektron dari yang lain. Untuk stabilisasi, mereka berbagi elektron dari orbit molekul luar dengan orang lain. | Ikatan ionik terbentuk antara logam dan non-logam. Non-logam (-Ve ion) lebih "lebih kuat" daripada logam (+ve ion) dan bisa mendapatkan elektron dengan sangat mudah dari logam. Dua ion yang berlawanan ini saling menarik dan membentuk ikatan ionik. |
| Terjadi antara | Dua non-logam | Satu logam dan satu non-logam |
| Elektron | Elektron dibagi dalam obligasi kovalen. | Dalam ikatan ionik, elektron ditransfer dari satu atom ke atom lainnya, menghasilkan dua ion bermuatan - satu bermuatan positif, dan satu bermuatan negatif. Kedua ion saling tertarik dan membentuk ikatan ionik. |
| Contoh | Metana (CH4), Hydro Chloric Acid (HCl) | Sodium klorida (NaCl), asam sulfat (H2SO4) |
| Titik lebur | Rendah | Tinggi |
| Larut dalam air? | Bervariasi | Ya |
| Polaritas | Rendah | Tinggi |
| Membentuk | Bentuk yang pasti | Tidak ada bentuk yang pasti |
| Titik didih | Rendah | Tinggi |
| Nyatakan pada suhu kamar | Cair atau gas | Padat |
| Konsistensi | Lembut | Rapuh |
Tentang ikatan kovalen dan ionik
Ikatan kovalen terbentuk ketika dua atom dapat berbagi elektron sedangkan ikatan ionik terbentuk ketika "berbagi" sangat tidak setara sehingga elektron dari atom A benar -benar hilang ke atom B, yang mengakibatkan sepasang ion.
Setiap atom terdiri dari proton, neutron dan elektron. Di tengah atom, neutron dan proton tetap bersama. Tapi elektron berputar di orbit di sekitar pusat. Masing -masing orbit molekul ini dapat memiliki sejumlah elektron untuk membentuk atom yang stabil. Tapi terlepas dari gas inert, konfigurasi ini tidak ada dengan sebagian besar atom. Jadi untuk menstabilkan atom, setiap atom berbagi setengah dari elektronnya.
Ikatan kovalen adalah bentuk ikatan kimia antara dua atom non logam yang ditandai dengan berbagi pasangan elektron antara atom dan ikatan kovalen lainnya. Ikatan ionik, juga dikenal sebagai ikatan elektrovalen, adalah jenis ikatan yang terbentuk dari daya tarik elektrostatik antara ion bermuatan yang berlawanan dalam senyawa kimia. Jenis ikatan ini terjadi terutama antara atom logam dan non logam.
Pembentukan dan contoh
Obligasi kovalen dibentuk sebagai hasil dari pembagian satu atau lebih pasangan elektron ikatan. Negatif elektro (kemampuan menarik elektron) dari dua atom terikat sama atau perbedaannya tidak lebih besar dari 1.7. Selama perbedaan elektro-negatif tidak lebih besar dari 1.7, atom hanya dapat berbagi elektron ikatan.
 Model ikatan karbon kovalen ganda dan tunggal di dalam cincin benzena.
Model ikatan karbon kovalen ganda dan tunggal di dalam cincin benzena. Misalnya, mari kita pertimbangkan molekul metana i.e.Ch4. Karbon memiliki 6 elektron dan konfigurasi elektroniknya adalah 1S22S22P2, i.e. ia memiliki 4 elektron di orbit luarnya. Menurut aturan octate (menyatakan bahwa atom cenderung mendapatkan, kehilangan, atau berbagi elektron sehingga setiap atom memiliki tingkat energi terluar penuh yang biasanya 8 elektron.), berada dalam keadaan stabil, ia membutuhkan 4 elektron lagi. Sehingga membentuk ikatan kovalen dengan hidrogen (1S1), dan dengan berbagi elektron dengan hidrogen itu membentuk metana atau ch4.
Jika perbedaan elektro-negatif lebih besar dari 1.7 Kemudian atom elektronegatif yang lebih tinggi memiliki kemampuan menarik elektron yang cukup besar untuk memaksa transfer elektron dari atom elektronegatif yang lebih rendah. Ini menyebabkan pembentukan ikatan ionik.
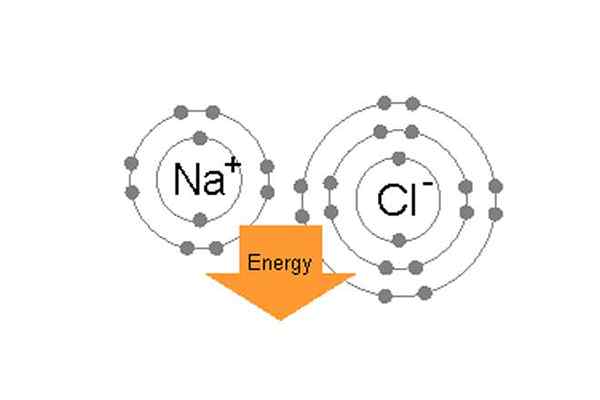
 Ikatan natrium dan klorin secara ionik untuk membentuk natrium klorida.
Ikatan natrium dan klorin secara ionik untuk membentuk natrium klorida. Misalnya, dalam garam meja umum (NaCl) atom individu adalah natrium dan klorin. Klorin memiliki tujuh elektron valensi di orbit luarnya tetapi berada dalam kondisi yang stabil, ia membutuhkan delapan elektron di orbit luar. Di sisi lain, natrium memiliki satu elektron valensi dan juga membutuhkan delapan elektron. Karena klorin memiliki elektro-negatif yang tinggi, 3.16 Dibandingkan dengan Sodium 0.9, (jadi perbedaan antara elektro-negativitas mereka lebih dari 1.7) Klorin dapat dengan mudah menarik satu elektron valensi natrium. Dengan cara ini mereka membentuk ikatan ionik, dan berbagi elektron satu sama lain dan keduanya akan memiliki 8 elektron di cangkang luarnya.
Karakteristik Obligasi
Ikatan kovalen memiliki bentuk yang pasti dan dapat diprediksi dan memiliki titik peleburan dan didih rendah. Mereka dapat dengan mudah dipecah menjadi struktur utamanya karena atom -atom dekat dengan elektron. Ini sebagian besar gas dan bahkan sedikit muatan negatif atau positif pada ujung yang berlawanan dari ikatan kovalen memberi mereka polaritas molekuler.
Ikatan ionik biasanya membentuk senyawa kristal dan memiliki titik leleh yang lebih tinggi dan titik didih dibandingkan dengan senyawa kovalen. Ini melakukan listrik dalam keadaan cair atau larutan dan mereka adalah ikatan yang sangat polar. Kebanyakan dari mereka larut dalam air tetapi tidak larut dalam pelarut non-polar. Mereka membutuhkan lebih banyak energi daripada ikatan kovalen untuk memecahkan ikatan di antara mereka.
Alasan untuk perbedaan dalam titik pencairan dan didih untuk ikatan ionik dan kovalen adalah bahwa jumlah energi yang diperlukan untuk mengganggu gaya antarmolekul antara molekul yang terbentuk melalui ikatan kovalen jauh lebih sedikit daripada energi yang dibutuhkan untuk memecah ikatan ionik dalam senyawa ion kristal dalam kristalik kristalik dalam kristalik kristal.

